题目内容
气体的实验室制法是一种重要的实验基本技能,请回顾二氧化碳的实验室制法,回答下列问题:
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
CO2
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
CaO+CO↑+CO2↑
⑤CO+Fe2O3
2Fe+3CO2
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:
(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
①分析上述数据可得到一个结论:
②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸
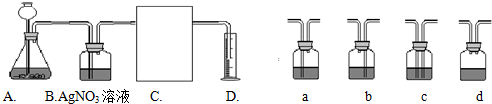
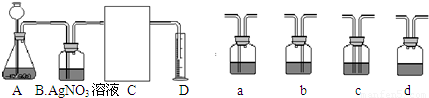
(3)下面是二氧化碳的制取、净化、收集和量气的相关实验
(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是
②实验过程B装置产生的主要实验现象是:
涉及化学反应是
③方线框中的C装置应该选择上面提供的a、b、c、d的
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
| ||
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
| ||
⑤CO+Fe2O3
| ||
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
.现提供有①纯净的CaCO3白色粉末,②大理石,③稀盐酸,③浓盐酸,④稀硫酸,⑤浓硫酸.其中最适合用于实验室制取二氧化碳的药品是②③
②③
(填代号)(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
| 密度(ρ)/g?ml-1 | 1.00 | 1.02 | 1.04 | 1.06 | 1.08 | 1.10 | 1.12 | 1.14 | 1.16 | 1.185 |
| 溶质质量分数(w)/% | 0.4 | 4.4 | 8.5 | 12.5 | 16.5 | 20.4 | 24.2 | 28.2 | 32.2 | 37.2 |
溶液质量分数越大,其密度也越大
溶液质量分数越大,其密度也越大
;盐酸是氯化氢气体溶于水得到的溶液,升高盐酸溶液的温度,其密度将变减小
减小
.②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸
40.1mL
40.1mL
ml.配制过程中要用到量筒、胶头滴管
胶头滴管
、烧杯、玻璃棒等仪器.(3)下面是二氧化碳的制取、净化、收集和量气的相关实验

(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是
分液漏斗比长颈漏斗能更方便的控制反应速率
分液漏斗比长颈漏斗能更方便的控制反应速率
②实验过程B装置产生的主要实验现象是:
产生白色沉淀
产生白色沉淀
;涉及化学反应是
AgNO3+HC═lAgCl↓+HNO3
AgNO3+HC═lAgCl↓+HNO3
.③方线框中的C装置应该选择上面提供的a、b、c、d的
a
a
.分析:(1)根据反应的特点及实验室中制取气体的要求来分析并完成解答;
(2)①分析表格中数据的特点,并结合气体物质的溶解度的影响因素来完成解答;
②根据溶液稀释前后溶质的质量不变并结合溶液的配制方法解答即可;
(3)①分液漏斗能更方便的控制反应速率,可以据此解答;
②硝酸银可以和盐酸反应,可以据此判断反应现象;
③根据除杂的要求来选择合适的装置.
(2)①分析表格中数据的特点,并结合气体物质的溶解度的影响因素来完成解答;
②根据溶液稀释前后溶质的质量不变并结合溶液的配制方法解答即可;
(3)①分液漏斗能更方便的控制反应速率,可以据此解答;
②硝酸银可以和盐酸反应,可以据此判断反应现象;
③根据除杂的要求来选择合适的装置.
解答:解:(1)反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集,故不适合实验室中制取二氧化碳;实验室中最适合制取二氧化碳的药品为大理石和稀盐酸,即②③;
(2)①分析表中数据可以知道,溶液质量分数越大,其密度也越大;气体的溶解度随温度的升高而减低,所以若升高温度,则盐酸中溶质的质量分数要减小;
②设需要溶质质量分数为37.2%的浓盐酸的体积为x
200mL×1.04g/mL×8.5%=x?37.2%×1.185g/mL
解得:x=40.1mL
配制过程中要用到量筒、胶头滴管、烧杯、玻璃棒等仪器.
(3)①分液漏斗比长颈漏斗能更方便的控制反应速率;
②硝酸银可以和盐酸反应,所以可以观察到B中产生白色沉淀,其反应为氯化氢和硝酸银反应生成了氯化银和硝酸;
③要除去气体中的杂质,必须将气体与除杂的试剂相接触,并且利于气体的排出,故应该选择装置a.
故答案为:(1)反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集;②③;
(2))①溶液质量分数越大,其密度也越大;减小;
②40.1mL;胶头滴管;
(3)①分液漏斗比长颈漏斗能更方便的控制反应速率;
②产生白色沉淀,AgNO3+HC═lAgCl↓+HNO3;
③a.
(2)①分析表中数据可以知道,溶液质量分数越大,其密度也越大;气体的溶解度随温度的升高而减低,所以若升高温度,则盐酸中溶质的质量分数要减小;
②设需要溶质质量分数为37.2%的浓盐酸的体积为x
200mL×1.04g/mL×8.5%=x?37.2%×1.185g/mL
解得:x=40.1mL
配制过程中要用到量筒、胶头滴管、烧杯、玻璃棒等仪器.
(3)①分液漏斗比长颈漏斗能更方便的控制反应速率;
②硝酸银可以和盐酸反应,所以可以观察到B中产生白色沉淀,其反应为氯化氢和硝酸银反应生成了氯化银和硝酸;
③要除去气体中的杂质,必须将气体与除杂的试剂相接触,并且利于气体的排出,故应该选择装置a.
故答案为:(1)反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集;②③;
(2))①溶液质量分数越大,其密度也越大;减小;
②40.1mL;胶头滴管;
(3)①分液漏斗比长颈漏斗能更方便的控制反应速率;
②产生白色沉淀,AgNO3+HC═lAgCl↓+HNO3;
③a.
点评:解答这类题目时,首先,要熟记实验室制取二氧化碳的反应原理、实验步骤、装置示意图及其中仪器的名称、注意事项等等.然后,根据所给的实验、问题情景信息,或者是图表信息等,结合所学的相关知识和技能,细心地探究后,按照题目要求进行选择、填写或评价实验室制取二氧化碳的实验步骤,或者画出、选配、评价装置示意图(或部分装置的示意图),等等

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
气体的实验室制法是一种重要的实验基本技能,请回顾二氧化碳的实验室制法,回答下列问题:
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2 CO2
CO2
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4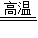 CaO+CO↑+CO2↑
CaO+CO↑+CO2↑
⑤CO+Fe2O3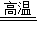 2Fe+3CO2
2Fe+3CO2
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:______.现提供有①纯净的CaCO3白色粉末,②大理石,③稀盐酸,③浓盐酸,④稀硫酸,⑤浓硫酸.其中最适合用于实验室制取二氧化碳的药品是______(填代号)
(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
①分析上述数据可得到一个结论:______;盐酸是氯化氢气体溶于水得到的溶液,升高盐酸溶液的温度,其密度将变______.
②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸______ml.配制过程中要用到量筒、______、烧杯、玻璃棒等仪器.
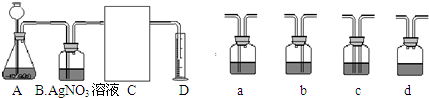
(3)下面是二氧化碳的制取、净化、收集和量气的相关实验
(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是______
②实验过程B装置产生的主要实验现象是:______;
涉及化学反应是______.
③方线框中的C装置应该选择上面提供的a、b、c、d的______.
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
 CO2
CO2②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
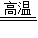 CaO+CO↑+CO2↑
CaO+CO↑+CO2↑⑤CO+Fe2O3
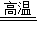 2Fe+3CO2
2Fe+3CO2…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:______.现提供有①纯净的CaCO3白色粉末,②大理石,③稀盐酸,③浓盐酸,④稀硫酸,⑤浓硫酸.其中最适合用于实验室制取二氧化碳的药品是______(填代号)
(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
| 密度(ρ)/g?ml-1 | 1.00 | 1.02 | 1.04 | 1.06 | 1.08 | 1.10 | 1.12 | 1.14 | 1.16 | 1.185 |
| 溶质质量分数(w)/% | 0.4 | 4.4 | 8.5 | 12.5 | 16.5 | 20.4 | 24.2 | 28.2 | 32.2 | 37.2 |
②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸______ml.配制过程中要用到量筒、______、烧杯、玻璃棒等仪器.
(3)下面是二氧化碳的制取、净化、收集和量气的相关实验

(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是______
②实验过程B装置产生的主要实验现象是:______;
涉及化学反应是______.
③方线框中的C装置应该选择上面提供的a、b、c、d的______.
 (2010?越秀区二模)某小组利用以下装置进行有关气体的实验室制法和性质的研究.
(2010?越秀区二模)某小组利用以下装置进行有关气体的实验室制法和性质的研究.