摘要:方法操作过程实验现象方法一 方法二
网址:http://m.1010jiajiao.com/timu_id_896281[举报]
实验课上,老师安排了分组实验,甲组同学制取O2,乙组同学制取CO2.
(1)实验室制取气体的发生装置和收集装置类型的确定应根据 (填序号)
a.化学药品的状态 b.发生化学反应的条件
c.生成气体的密度和在水中的溶解性
(2)甲组同学若用高锰酸钾制取氧气,反应方程式为 ,若用双氧水和二氧化锰制氧气,二氧化锰在该反应中起 作用,从反应后的混合物中回收二氧化锰的操作方法是 .
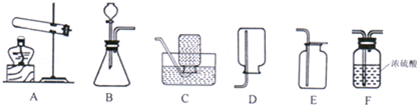
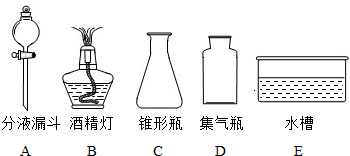
(3)乙组同学制取CO2的反应方程式 ,其发生装置和收集装置的装配,应选用的仪器有:带导管的双孔塞、玻璃片以及下图所示中的 (填标号)等.
(4)学校实验室的废液缸中收集了同学们在实验室用石灰石和稀盐酸制取CO2后的残留废液.小红同学想探究废液中溶质的成分,请你一同参与探究并回答下列问题.
[提出问题]废液中的溶质是什么物质?
[作出猜想]小红认为废液中溶质只有CaCl2.
你认为还可能含有的溶质是 (填化学式).
[查阅资料]CaCl2溶液呈中性.
[实验与结论]
①小红分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液作对比实验,结果两试管中溶液均为无色,于是小红认为自己的猜想是正确的.
②你认为小红的实验 (填“能”或“不能”)证明她的猜想,理由是 .
③设计实验,验证你的猜想是正确的:
方案一:选用碳酸盐作试剂.
方案二:你选择的试剂是 (填化学式,与方案一物质类别不同).实验中可以看到的现象是 .
[拓展与应用]
①若实验证明你的猜想是正确的,要想使处理后的废液只有CaCl2溶液,应向废液中加入过量的 ,反应完成后过滤.
②通过以上探究,你认为实验室的废液未经处理直接倒入下水道,可能造成的危害是 (写一条)
查看习题详情和答案>>
(1)实验室制取气体的发生装置和收集装置类型的确定应根据
a.化学药品的状态 b.发生化学反应的条件
c.生成气体的密度和在水中的溶解性
(2)甲组同学若用高锰酸钾制取氧气,反应方程式为
(3)乙组同学制取CO2的反应方程式

(4)学校实验室的废液缸中收集了同学们在实验室用石灰石和稀盐酸制取CO2后的残留废液.小红同学想探究废液中溶质的成分,请你一同参与探究并回答下列问题.
[提出问题]废液中的溶质是什么物质?
[作出猜想]小红认为废液中溶质只有CaCl2.
你认为还可能含有的溶质是
[查阅资料]CaCl2溶液呈中性.
[实验与结论]
①小红分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液作对比实验,结果两试管中溶液均为无色,于是小红认为自己的猜想是正确的.
②你认为小红的实验
③设计实验,验证你的猜想是正确的:
方案一:选用碳酸盐作试剂.
方案二:你选择的试剂是
[拓展与应用]
①若实验证明你的猜想是正确的,要想使处理后的废液只有CaCl2溶液,应向废液中加入过量的
②通过以上探究,你认为实验室的废液未经处理直接倒入下水道,可能造成的危害是
实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气.
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
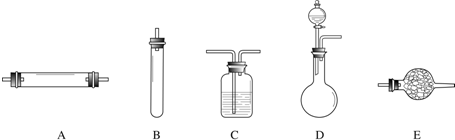
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置
(3)方法三:制氮气的化学方程式为:
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂.在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
(5)1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
查看习题详情和答案>>
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气.
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):

(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
D
D
(选填装置编号).请写出生石灰在此反应中的两个作用:生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度)
生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度)
,生石灰与水反应,减少了溶剂
生石灰与水反应,减少了溶剂
.(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置
E
E
(选填装置编号)中加入碱石灰
碱石灰
以除去其它杂质气体.(3)方法三:制氮气的化学方程式为:
NaNO2+NH4Cl
NaCl+N2↑+2H2O
| ||
NaNO2+NH4Cl
NaCl+N2↑+2H2O
.
| ||
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂.在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染)
铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染)
.(5)1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
.实验课上,某小组的同学用生石灰进行“化学反应中能量的变化”实验时发现:向块状生石灰中加入适量水后没有明显的温度变化.为确定其原因,进行了如下实验探究.
【提出问题】生石灰是否变质?其成分是什么?
【查阅资料】氢氧化钙溶解过程中无明显温度变化,与盐酸反应无气体生成.
【猜想与假设】同学们认为生石灰样品已经变质,并对其成分作出了如下4种猜想.
猜想1:氧化钙和氢氧化钙;
猜想2:氧化钙和碳酸钙;
猜想3:
猜想4:氧化钙、氢氧化钙和碳酸钙.
【进行实验】同学们将少量样品研碎后,按如图所示过程进行实验.
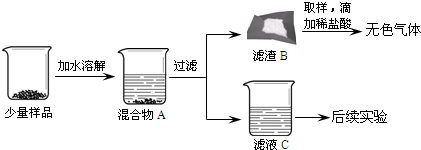
(1)在溶解过程中用温度计测量液体的温度,发现温度计示数升高,说明样品中应该含有
结论:猜想3不成立.
(2)滤渣B中一定含有
结论:①块状生石灰表面发生变质;②猜想1不成立.
(3)为验证滤液C的成分,进行后续实验.
【反思与评价】
上述实验过程能否得出猜想4成立、猜想2不成立的结论,理由是
查看习题详情和答案>>
【提出问题】生石灰是否变质?其成分是什么?
【查阅资料】氢氧化钙溶解过程中无明显温度变化,与盐酸反应无气体生成.
【猜想与假设】同学们认为生石灰样品已经变质,并对其成分作出了如下4种猜想.
猜想1:氧化钙和氢氧化钙;
猜想2:氧化钙和碳酸钙;
猜想3:
Ca(OH)2和CaCO3[或CaCO3或Ca(OH)2]
Ca(OH)2和CaCO3[或CaCO3或Ca(OH)2]
;猜想4:氧化钙、氢氧化钙和碳酸钙.
【进行实验】同学们将少量样品研碎后,按如图所示过程进行实验.

(1)在溶解过程中用温度计测量液体的温度,发现温度计示数升高,说明样品中应该含有
CaO
CaO
.结论:猜想3不成立.
(2)滤渣B中一定含有
CaCO3
CaCO3
,用化学方程式表示生成该物质的反应CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.结论:①块状生石灰表面发生变质;②猜想1不成立.
(3)为验证滤液C的成分,进行后续实验.
| 实验操作 | 实验现象 | 实验结论 |
取适量滤液C于试管中,向其中通入适量二氧化碳,观察 取适量滤液C于试管中,向其中通入适量二氧化碳,观察 |
滤液变浑浊 滤液变浑浊 |
①滤液中溶质为氢氧化钙 ②猜想4成立,猜想2不成立 |
上述实验过程能否得出猜想4成立、猜想2不成立的结论,理由是
不能.因为样品中有氧化钙,加水后能和水反应生成氢氧化钙,所以无法证明生石
灰样品中含有氢氧化钙
灰样品中含有氢氧化钙
不能.因为样品中有氧化钙,加水后能和水反应生成氢氧化钙,所以无法证明生石
灰样品中含有氢氧化钙
.灰样品中含有氢氧化钙
①实验室制取二氧化碳,结合实验装置图回答有关问题
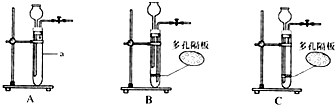
Ⅰ.仪器a的名称是
Ⅱ.用大理石和稀盐酸制取二氧化碳,写出该反应的化学方程式是:
Ⅲ.能随时控制反应的发生和停止的装置是
②制取二氧化碳后剩余溶液的成分探究(CO2已完全放出,杂质不溶于水且不参加反应):
甲、乙同学分析认为剩余溶液中一定有氯化钙,可能有盐酸.为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论.
查找资料:氯化钙溶液呈中性
丙同学取样于试管中,滴加硝酸银溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,由此得出和甲、乙一致的结论.甲、乙认为丙的实验设计不合理.理由是
查看习题详情和答案>>

Ⅰ.仪器a的名称是
试管
试管
.Ⅱ.用大理石和稀盐酸制取二氧化碳,写出该反应的化学方程式是:
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.Ⅲ.能随时控制反应的发生和停止的装置是
C
C
(填编号).②制取二氧化碳后剩余溶液的成分探究(CO2已完全放出,杂质不溶于水且不参加反应):
甲、乙同学分析认为剩余溶液中一定有氯化钙,可能有盐酸.为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论.
查找资料:氯化钙溶液呈中性
| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取样于试管中,滴加 紫色石蕊 紫色石蕊 试液 |
试液变红 | 有盐酸 |
| 乙 | 取样于试管中,逐滴滴加碳酸钠溶液至过量 | 有气泡冒出 有气泡冒出 |
氯化钙溶液中也有氯离子,会出现同样的现象
氯化钙溶液中也有氯离子,会出现同样的现象
.