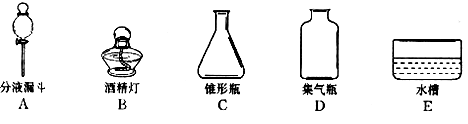
题目内容
实验课上,老师安排了分组实验,甲组同学制取O2,乙组同学制取CO2.(1)实验室制取气体的发生装置和收集装置类型的确定应根据
a.化学药品的状态 b.发生化学反应的条件
c.生成气体的密度和在水中的溶解性
(2)甲组同学若用高锰酸钾制取氧气,反应方程式为
(3)乙组同学制取CO2的反应方程式
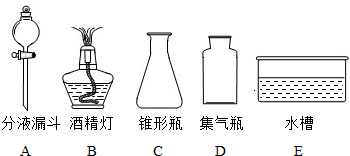
(4)学校实验室的废液缸中收集了同学们在实验室用石灰石和稀盐酸制取CO2后的残留废液.小红同学想探究废液中溶质的成分,请你一同参与探究并回答下列问题.
[提出问题]废液中的溶质是什么物质?
[作出猜想]小红认为废液中溶质只有CaCl2.
你认为还可能含有的溶质是
[查阅资料]CaCl2溶液呈中性.
[实验与结论]
①小红分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液作对比实验,结果两试管中溶液均为无色,于是小红认为自己的猜想是正确的.
②你认为小红的实验
③设计实验,验证你的猜想是正确的:
方案一:选用碳酸盐作试剂.
方案二:你选择的试剂是
[拓展与应用]
①若实验证明你的猜想是正确的,要想使处理后的废液只有CaCl2溶液,应向废液中加入过量的
②通过以上探究,你认为实验室的废液未经处理直接倒入下水道,可能造成的危害是
分析:(1)根据发生装置和收集装置的选择依据即可.
(2)根据氧气的实验室制法即可.
(3)根据二氧化碳的实验室制法和反应装置即可.
(4)
[作出猜想]盐酸可能会剩余.
[实验与结论]
②根据酸和碱遇到指示剂的颜色变化即可.
③只要可以和盐酸反应,并且有明显现象即可.
[拓展与应用]
①根据除杂的条件即可.
②答案合理即可.
(2)根据氧气的实验室制法即可.
(3)根据二氧化碳的实验室制法和反应装置即可.
(4)
[作出猜想]盐酸可能会剩余.
[实验与结论]
②根据酸和碱遇到指示剂的颜色变化即可.
③只要可以和盐酸反应,并且有明显现象即可.
[拓展与应用]
①根据除杂的条件即可.
②答案合理即可.
解答:解:
(1)常见的发生装置有三种,①固体和固体加热制气体,②固体和液体不加热,③固体和液体加热;收集装置常见的也有三种,①气体不溶于水,采用排水法,②密度比空气大,采用向上排空气法,③密度比空气小,采用向下排空气法;故答案为:a、b、c.
(2)这是氧气的实验室制法之一,故答案为:2KMnO4
K2MnO4+MnO2+O2↑,催化,过滤;
(3)这是二氧化碳的实验室制法,发生装置属于固体和液体不加热制取气体,收集装置属于向上排空气法收集;故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑,A、C、D.
(4)
[作出猜想]:实验室用石灰石和稀盐酸制取CO2,反应后,盐酸可能有剩余,故答案为:HCl.
[实验与结论]
②CaCl2是中性,HCl是酸性,中性物质和酸性物质都不能使酚酞颜色发生变化,故答案为:不能,酚酞遇酸也不变色③盐酸能够是石蕊试液变红,但是CaCl2不能使石蕊变红,所以可用石蕊.故答案为:石蕊,石蕊试液变红.(其它答案合理均可).
①CaCO3 和盐酸反应生成CaCl2和二氧化碳和水,剩余的碳酸钙过滤即可,故答案为:CaCO3.
②根据酸的性质可知,故答案为:腐蚀铁质水管,污染水源等.
(1)常见的发生装置有三种,①固体和固体加热制气体,②固体和液体不加热,③固体和液体加热;收集装置常见的也有三种,①气体不溶于水,采用排水法,②密度比空气大,采用向上排空气法,③密度比空气小,采用向下排空气法;故答案为:a、b、c.
(2)这是氧气的实验室制法之一,故答案为:2KMnO4
| ||
(3)这是二氧化碳的实验室制法,发生装置属于固体和液体不加热制取气体,收集装置属于向上排空气法收集;故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑,A、C、D.
(4)
[作出猜想]:实验室用石灰石和稀盐酸制取CO2,反应后,盐酸可能有剩余,故答案为:HCl.
[实验与结论]
②CaCl2是中性,HCl是酸性,中性物质和酸性物质都不能使酚酞颜色发生变化,故答案为:不能,酚酞遇酸也不变色③盐酸能够是石蕊试液变红,但是CaCl2不能使石蕊变红,所以可用石蕊.故答案为:石蕊,石蕊试液变红.(其它答案合理均可).
①CaCO3 和盐酸反应生成CaCl2和二氧化碳和水,剩余的碳酸钙过滤即可,故答案为:CaCO3.
②根据酸的性质可知,故答案为:腐蚀铁质水管,污染水源等.
点评:这个题涉及知识要点较多,掌握发生装置和收集装置的选择条件以及常见气体的实验室制法,掌握除杂的要求和指示剂的颜色变化规律.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
 (3)乙组同学制取CO2的反应化学方程式 ,其发生装置和收集装置的装配,应选用的仪器有:带导管的双孔塞、玻璃片以及下图所示中的 (填标号)等.
(3)乙组同学制取CO2的反应化学方程式 ,其发生装置和收集装置的装配,应选用的仪器有:带导管的双孔塞、玻璃片以及下图所示中的 (填标号)等.
 (3)乙组同学制取CO2的反应化学方程式 ,其发生装置和收集装置的装配,应选用的仪器有:带导管的双孔塞、玻璃片以及下图所示中的 (填标号)等.
(3)乙组同学制取CO2的反应化学方程式 ,其发生装置和收集装置的装配,应选用的仪器有:带导管的双孔塞、玻璃片以及下图所示中的 (填标号)等.