网址:http://m.1010jiajiao.com/timu_id_894233[举报]
化学就在我们身边
(1)萌萌是个爱劳动的孩子,平时自己的衣物总是自己清洗,她发现用湿手取少量洗衣粉时感觉到手发烫,原因是洗衣粉溶于水 (填“放热”或“吸热“)。生活用水在净化过程中常用 吸附色素和异味,一般可以通过 的方法降低水的硬度。
(2)阅读文字,在横线上写出相应的化学方程式:
安全火柴的火柴头上主要含有氯酸钾、二氧化锰、硫和玻璃粉等,火柴杆上涂有少量的石蜡,火柴盒两边的摩擦层是由红磷和玻璃粉调和而成的。火柴着火的主要过程是:
①火柴头在火柴盒上划动时,产生的热量使红磷燃烧; 。
②红磷燃烧放出的热量使氯酸钾分解; 。
③氯酸钾分解放出的氧气与硫在点燃条件下反应; 。
④硫与氧气反应放出的热量引燃石蜡(C25H32),石蜡燃烧的产物是二氧化碳和水,最终使火柴杆着火。 。
(3)汽车给人们生活带来巨大便利的同时也带来了严重的空气污染;汽车发动机是将空气与汽油(设汽油主要成分为:C8H18)以一定的比例混合成良好的混合气,被吸入汽缸,经压缩后由高压放电点火燃烧而产生热能,高温高压的气体作用于活塞顶部,推动活塞作往复运动,从而产生动力,发动机再将燃烧后的废气排出;经过研究发现,汽车尾气中含有NO、CO等有害气体。试着回答下列问题:
①尾气中的NO是在发动机中高压放电或者高温的时候经过化合反应产生,试写出该反应的方程式:_______________________________________________________
②汽车尾气中的CO在四氧化三钴(Co3O4)纳米棒的催化作用下,低温即与O2反应生成CO2.下列关于该反应的说法中,不正确的是( )
| A.反应类型为化合反应 | B.可降低汽车尾气对大气的污染 |
| C.反应前后Co3O4质量改变 | D.反应前后碳元素的化合价改变 |
(一)某实验小组设计了下图所示的实验装置。

⑴ 写出仪器A的名称
⑵ 甲同学认为打开K1、关闭K2时,利用I、Ⅱ装置,可以制取并收集氧气,该化学反应方程式为 : 。
⑶乙同学认为利用Ⅰ、Ⅲ装置可以测定空气中氧气的含量。关闭K、K1、K2,用凸透镜引燃B中的白磷,待冷却后打开K2,整个实验过程中能观察到的现象是:① ;② 。
⑷ 丙同学认为可以利用Ⅰ、Ⅲ装置验证二氧化碳能与氢氧化钠溶液发生反应。他在广口瓶B中预先收集满二氧化碳气体,在仪器A中盛放氢氧化钠浓溶液,烧杯中盛放稀盐酸, K1关闭、K2打开,然后打开K将氢氧化钠浓溶液滴入广口瓶中,关闭K,依据 现象,可以证明二氧化碳能与氢氧化钠溶液发生化学反应。
(二)甲、乙两同学对有关镁与盐酸的反应进行了系列研究(如图)

探究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:`
⑴实验时需将镁条进行打磨,其目的是 。
⑵反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应,化学方程式为 。
⑶实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,你认为在t1~t2时间内反应速率逐渐加快的主要原因是: 。

探究二:.反应后所得溶液的酸碱性探究
【发现问题】
⑴反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈 性,(选填“酸”“碱”或“中”)。
⑵反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,溶液变红。
【查阅资料】氢氧化镁微溶于热水,且溶解度随温度升高而增大。
【提出猜想】
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;
猜想Ⅱ:氯化镁溶液pH小于7。
乙同学:猜想Ⅰ:氯化镁溶液呈碱性使酚酞变成红色;
猜想Ⅱ:镁与热水反应后生成碱使酚酞变红色。
【实验与思考】
⑴为验证猜想,甲、乙两同学均需测定____溶液的酸碱性,实验表明该溶液显弱酸性。
⑵乙同学为验证猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气泡产生,收集并点燃该气体,发现气体能燃烧,请根据以上现象写出镁与热水反应的化学方程式 ;
⑶乙同学在进行上述猜想Ⅱ的探究时,发现实验一段时间后,酚酞的红色总是会逐渐消失,于是他猜想可能是镁与热水反应后生成的碱逐渐被空气中的二氧化碳反应掉了,但甲同学猜想可能是水温逐渐降低,导致 ,请你设计一个简单的实验方案验证甲或乙的猜想是否成立 (写出相应的操作、现象和结论): 。
【结论】
镁与稀盐酸反应,若镁反应完全后所得溶液显酸性,若镁过量时所得溶液显碱性。

请你参与探究并回答下列问题.
(1)用A、D组合,可以制取一种气体,其反应的化学方程式是
| ||
| △ |
| ||
| △ |
从反应物的状态、反应条件等方面总结选择该发生装置需满足的一般条件
(2)该兴趣小组的同学设计如图2实验装置进行气体的制取与收集实验.
①写出图中有标号仪器的名称:A
②装置有一处设计明显错误,请指出并改正:
③用改正后的装置进行如下实验:
李军同学想利用该装置制取和收集干燥纯净的氧气,写出甲中反应的化学方程式:
| ||
| ||
小芳和小明想利用上述改正后装置制取干燥的H2和CO2,请对他们的方案给予评价.
| 制取的气体 | 甲中盛放的试剂 | 乙中盛放的试剂 | 评价(回答是否可行,若不可行说明理由) |
| H2 | 锌粒和稀硫酸 | 浓H2SO4 | 不可行,因为氢气的密度比空气小,应用向下排空气法收集 不可行,因为氢气的密度比空气小,应用向下排空气法收集 |
| CO2 | 大理石和稀盐酸 | 浓NaOH溶液 | 不可行,因为二氧化碳与氢氧化钠溶液可反应,收集不到气体 不可行,因为二氧化碳与氢氧化钠溶液可反应,收集不到气体 |
某化学兴趣小组的同学利用如图1装置进行实验室制取气体的探究.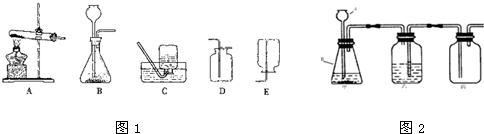
请你参与探究并回答下列问题.
(1)用A、D组合,可以制取一种气体,其反应的化学方程式是______;
从反应物的状态、反应条件等方面总结选择该发生装置需满足的一般条件______.
(2)该兴趣小组的同学设计如图2实验装置进行气体的制取与收集实验.
①写出图中有标号仪器的名称:A______.
②装置有一处设计明显错误,请指出并改正:______.
③用改正后的装置进行如下实验:
李军同学想利用该装置制取和收集干燥纯净的氧气,写出甲中反应的化学方程式:______,乙中物质应为______,检验气体是否集满的方法是______.
小芳和小明想利用上述改正后装置制取干燥的H2和CO2,请对他们的方案给予评价.
| 制取的气体 | 甲中盛放的试剂 | 乙中盛放的试剂 | 评价(回答是否可行,若不可行说明理由) |
| H2 | 锌粒和稀硫酸 | 浓H2SO4 | ______ |
| CO2 | 大理石和稀盐酸 | 浓NaOH溶液 | ______ |
【查阅资料】水垢的主要成分有Mg(OH)2、CaCO3 和MgCO3中的一种或多种
【设计方案】
实验1:确定水垢中是否含MgCO3
利用下列实验装置,完成实验探究.其主要实验步骤发下:

称量D、E装置总质量为600.00g,按上图组装后,将2.50g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为601.25g (碱石灰主要成分为CaO和NaOH,不考虑装置内空气对实验的影响).
【实验讨论】
(1)装置B中生成气体的化学方程式为
(2)装置B中生成CO2的质量为
(3)水垢中是否含MgCO3?
小组的同学经讨论认为测定一定质量的CaCO3与足量盐酸反应生成的二氧化碳质量,就可以确定.请你通过计算说明水垢中是否含MgCO3?
实验2:确定水垢中是否含有Mg(OH)2?
(4)另取质量为2.50g的水垢,加入3.65%的稀盐酸与之反应,测得消耗稀盐酸w g..结合以上实验结论,判断w的值满足