摘要:含
网址:http://m.1010jiajiao.com/timu_id_883262[举报]
含有Mg2+ Cu2+ Cl-SO42-四种离子的溶液,其中离子个数比为Mg2+:Cu2+:Cl-=1:3:2,加入适量的镁粉反应后,其中离子个数比为Cu2+:Cl-:SO42-=1:2:3,则Mg2+与Cl-SO42-的离子个数比为( )
| A、1:3:3 | B、1:2:3 | C、3:2:3 | D、2:2:3 |
含杂质30%的铁矿石(主要成分是Fe3O4)中铁元素的质量分数为多少?某工厂用这种铁矿石炼铁,若日产生铁中含铁的质量为120吨,则每天要消耗铁矿石多少吨?(已知杂质中不含铁元素)
查看习题详情和答案>>
含有杂质质量分数为10%的大理石50g跟足量的盐酸反应能产生二氧化碳多少升?(二氧化碳在标准状况下的密度约为1.98g/L)若将产生的二氧化碳全部通入足量的澄清的石灰水中,能得到沉淀多少克?
查看习题详情和答案>>
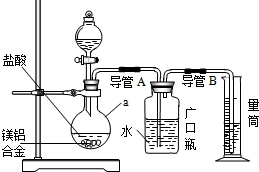 含镁3%一5%的镁铝合金是轮船制造、化工生产、机械制造等行业的重要原材料.现有一块质量为W 9的镁铝合金,某研究性学习小组欲测定其中镁的质量分数.
含镁3%一5%的镁铝合金是轮船制造、化工生产、机械制造等行业的重要原材料.现有一块质量为W 9的镁铝合金,某研究性学习小组欲测定其中镁的质量分数.查阅资料:溶液反应生成易溶于水的偏铝酸钠(NaAlO2)和H2,化学方程式为:2A1+2NaOH+2H20=2NaAlO2+3H2↑;镁不与NaOH溶液反应.氢氧化铝能与氢氧化钠溶液发生反应生成易溶于水的偏铝酸钠(NaAlO2)和H20,化学方程式为:A1(OH)3+NaOH=NaAlO2+2H20;氢氧化镁不与氢氧化钠溶液反应.
提出猜想:利用镁铝与酸、铝与碱、氢氧化铝与碱反应的化学性质来测定合金中镁的质量分数.
设计方案:研究小组设计了不同的实验方案.
方案l:镁铝合金与过量盐酸反应测定生成气体在标准状况下的体积为v1L;
方案2:镁铝合金与过量NaOH溶液充分反应后,过滤、洗涤、干燥、称量剩余固
体的质量为w1g;
方案3:镁铝合金与过量盐酸溶液反应后再与过量NaOH溶液反应,过滤、洗涤、
干燥、称量沉淀的质量为w2g.
问题讨论:请你参与研究小组的研究过程,并回答有关问题:
(1)研究小组利用上图所示实验装置,按照方案1进行了实验.
①装置中仪器a的名称是
②实验装置中有一处明显错误,请指出
(2)方案2中剩余固体是
(3)方案3中“过滤”得到的沉淀是
(4)某同学又设计了与上述方案原理不同的方案4,也能测得镁的质量分数.请你在横线上填写合适的内容,将该方案补充完整.
方案4:镁铝合金与
方案评价;
(5)在实验方案1-4中,你认为最佳的实验方案是