摘要:31.有关酸.碱.盐的探究 (1)酸.碱.盐溶解性表是学习化学的重要工具.右表列出了“部分酸.碱.盐在20℃时的溶解性 .
网址:http://m.1010jiajiao.com/timu_id_880838[举报]
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)下图是某试剂瓶标签上的内容.要把12 g这种浓硫酸稀释为20%的硫酸,需要水的质量为 g.

稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因 .
(3)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是 .
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验..请将下表填写完整.
(4)若73 g质量分数为10%的盐酸与130g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
查看习题详情和答案>>
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)下图是某试剂瓶标签上的内容.要把12 g这种浓硫酸稀释为20%的硫酸,需要水的质量为

稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因
(3)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验..请将下表填写完整.
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的Ba(NO3)2溶液,充分反应后过滤 | 有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 该样品中含有氢氧化钠 |
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)右图是某试剂瓶标签上的内容.要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为 g.稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
(3)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是 .
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.
请根据上图部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
查看习题详情和答案>>
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)右图是某试剂瓶标签上的内容.要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84/cm3 质量分数:98% |
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.
| 阴离子 阳离子 |
OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的 |
有白色沉淀生成 | 有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
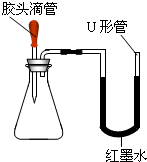 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.(1)盐酸、硫酸等具有相似的化学性质,是因为二者的水溶液中都含有
(2)如图是甲同学设计的趣味实验装置,其气密性良好.若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后能观察到什么现象?并写出有关反应的化学方程式.
(3)盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.乙同学和丙同学对这种白色粉末的成分进行了如下猜想和验证.
(Ⅰ)可能是NaOH(Ⅱ)可能是Na2CO3(Ⅲ)可能是NaOH与Na2CO3的混合物
①乙同学向所取少量粉末中滴加一种溶液后,排除了(Ⅰ)的可能性.请你推测他所加的试剂和观察到的现象.
②丙同学提议用酚酞试液来鉴定,你认为可行吗?请简要说明理由.
(4)某同学对附近一家化工厂排放的污水中的氢氧化钠含量进行了测定.他取了40g污水于烧杯中,逐滴加入5%的稀盐酸中和,当恰好完全反应时,用去稀盐酸7.3g.请计算废水中氢氧化钠的质量分数. 查看习题详情和答案>>
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是因为
盐酸具有挥发性,浓盐酸的瓶口有白雾,而浓硫酸的瓶口没有白雾
盐酸具有挥发性,浓盐酸的瓶口有白雾,而浓硫酸的瓶口没有白雾
(2)右图是某试剂瓶标签上的内容.要把10 g这种浓硫酸稀释为20%的硫酸,需要水的质量为
39
39
g.稀释浓硫酸时,不可将水倒进浓硫酸里,这是因为
浓硫酸的密度大,水的密度较小,如果将水倒进浓硫酸里,水浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,造成危险
浓硫酸的密度大,水的密度较小,如果将水倒进浓硫酸里,水浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,造成危险
.(3)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
稀盐酸
稀盐酸
.②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰;氯化钠溶液呈中性.
部分物质的溶解性表(20℃)
| 阴离子 阳离子 |
OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的 BaCl2 BaCl2 溶液,充分反应后过滤 |
有白色沉淀生成 | 有关反应的化学方程式为 Na2CO3+BaCl2═BaCO3↓+2NaCl Na2CO3+BaCl2═BaCO3↓+2NaCl |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 滤液变为红色 滤液变为红色 |
该样品中含有氢氧化钠 |
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验..请将下表填写完整.
(2)若73 g质量分数为10%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
查看习题详情和答案>>
(1)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
盐酸
盐酸
.②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验..请将下表填写完整.
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的 氯化钡 氯化钡 溶液,充分反应后过滤 |
有白色沉淀生成 | 有关反应的化学方程式为 Na2CO3+BaCl2=BaCO3↓+2NaCl Na2CO3+BaCl2=BaCO3↓+2NaCl |
| 检验是否含有氢氧化钠 | 向过滤后的滤液中滴入几滴酚酞试液 | 溶液变红色 溶液变红色 |
该样品中含有氢氧化钠 |