摘要:C.当V (A)=2 (C)时.可判断反应达到平衡状态 D.若相同条件下.起始时放入3molA和3n molB.则达平衡时生成3a molC.
网址:http://m.1010jiajiao.com/timu_id_77479[举报]
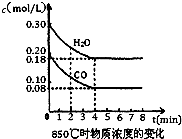 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.(1)850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示,下列说法正确的是
AD
AD
(填序号).A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
(2)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2.若要使上述反应开始时向正反应方向进行,则x应满足的条件是
x<3
x<3
.(3)如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+
| 1 | 2 |
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是
CO2(g)+4H2(g)═CH4(g)+2H2O(l)△H=-252.9kJ/mol
CO2(g)+4H2(g)═CH4(g)+2H2O(l)△H=-252.9kJ/mol
.(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为
CH4+4CO32--8e-=5CO2+2H2O
CH4+4CO32--8e-=5CO2+2H2O
,正极反应式为O2+2CO2+4e-=2CO32-
O2+2CO2+4e-=2CO32-
.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环,则A物质的化学式是CO2
CO2
.实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH444.8
44.8
L.已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
(1)850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示,下列说法正确的是______(填序号).
A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
(2)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2.若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
(3)如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+
O2(g)═H2O(l)△H2=-285.8kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是______.
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为______,正极反应式为______.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环,则A物质的化学式是______.实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4______L.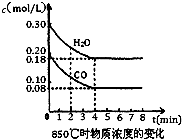
查看习题详情和答案>>
(1)850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示,下列说法正确的是______(填序号).
A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
(2)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2.若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
(3)如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+
| 1 |
| 2 |
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是______.
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为______,正极反应式为______.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环,则A物质的化学式是______.实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4______L.

已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
(1)850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示,下列说法正确的是______(填序号).
A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
(2)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2.若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
(3)如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+ O2(g)═H2O(l)△H2=-285.8kJ/mol
O2(g)═H2O(l)△H2=-285.8kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是______.
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为______,正极反应式为______.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环,则A物质的化学式是______.实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4______L.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示,下列说法正确的是______(填序号).
A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
(2)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2.若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
(3)如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+
 O2(g)═H2O(l)△H2=-285.8kJ/mol
O2(g)═H2O(l)△H2=-285.8kJ/mol则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是______.
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为______,正极反应式为______.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环,则A物质的化学式是______.实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4______L.
 查看习题详情和答案>>
查看习题详情和答案>>
| 运用化学反应原理可以更好的分析化学反应的本质 。 (1)下列四组物质反应,其中与其它三组有本质不同的是_______。 A.Na2O2 + H2O B.F2 + H2O C.Cl2 + H2O D.NO2 + H2O (2)在 25℃下,向浓度均为 0.1mol·L-1 的NaCl和KBr混合溶液中逐滴加入硝酸银溶液,先生成_______沉淀 ( 填化学式 );当两种沉淀共存时溶液中 (3) 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)  N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: | ||||||||
 | ||||||||
① 2NO(g)+2CO(g) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) ②若温度为Tl 、T2, 反应的平衡常数分别为 Kl、K2, 则K1_____K2;若反应进行到状态D 时,V正___V逆(填“>”、“<”或“=”) ③在恒容的密闭容器中,该反应达平衡后,改变某一条件,下列示意图不正确的是 | ||||||||
 | ||||||||
| (4)分析下表提供的数据: | ||||||||
| ||||||||
| ① 84 消毒液 ( 有效成分为 NaClO) 久置于空气中会失效,写出发生反应的离子方程式:____________; __________________。 ②判断在等浓度的 NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序:_________________。 |
 Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:(1)该反应的反应物是
A
A
.(2)反应物的转化率是
40%
40%
.(3)该反应的化学方程式为
2A?B+3C
2A?B+3C
.Ⅱ:(7分)在体积为2L的恒容密闭容器中存在以下反应:
CH3OH(g)+H2O(g)?CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)判断该可逆反应达到平衡状态的依据是(填序号)
CD
CD
.A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
(2)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方向移动的是
BCF
BCF
(填序号).A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出水蒸气.