题目内容
 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
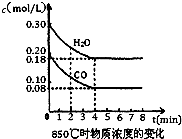
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.(1)850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示,下列说法正确的是
AD
AD
(填序号).A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
(2)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2.若要使上述反应开始时向正反应方向进行,则x应满足的条件是
x<3
x<3
.(3)如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+
| 1 | 2 |
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是
CO2(g)+4H2(g)═CH4(g)+2H2O(l)△H=-252.9kJ/mol
CO2(g)+4H2(g)═CH4(g)+2H2O(l)△H=-252.9kJ/mol
.(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为
CH4+4CO32--8e-=5CO2+2H2O
CH4+4CO32--8e-=5CO2+2H2O
,正极反应式为O2+2CO2+4e-=2CO32-
O2+2CO2+4e-=2CO32-
.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环,则A物质的化学式是CO2
CO2
.实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH444.8
44.8
L.分析:(1)A.根据一氧化碳或水蒸气与反应热的关系计算;
B.相对分子质量与其摩尔质量在数值上相等,根据质量和物质的量计算其摩尔质量;
C.升高温度,平衡向吸热反应方向移动,根据反应物和生成物浓度变化判断;
D.增大反应物浓度,平衡向正反应方向移动;
(2)要使平衡向正反应方向移动,则浓度商应该大于平衡常数;
(3)根据盖斯定律计算;
(4)负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;二氧化碳参加反应,所以要不断补充二氧化碳,根据氧气和甲烷之间的关系式计算.
B.相对分子质量与其摩尔质量在数值上相等,根据质量和物质的量计算其摩尔质量;
C.升高温度,平衡向吸热反应方向移动,根据反应物和生成物浓度变化判断;
D.增大反应物浓度,平衡向正反应方向移动;
(2)要使平衡向正反应方向移动,则浓度商应该大于平衡常数;
(3)根据盖斯定律计算;
(4)负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;二氧化碳参加反应,所以要不断补充二氧化碳,根据氧气和甲烷之间的关系式计算.
解答:解:(1)A.1.2mol水蒸气参加反应,通常条件下放出的热量为41.2kJ/mol×1.2mol=49.44kJ,故A正确;
B.由图可知4min时到达平衡,随反应进行,混合气体总质量不变,总物质的量不变,平均相对分子质量始终不变,所以不能作为平衡状态的判断依据,故B错误;
C.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,故C错误;
D.第8min时,若充入CO,反应物浓度增大,会导致v(正)>v(逆),平衡向正反应方向移动,故D正确;
故选AD;
(2)由图可知,平衡时CO的浓度为0.08mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.12 0.12 0.12 0.12
变化(mol/L):0.08 0.18 0.12 0.12
故平衡常数k=
=1,
平衡向正反应方向移动,浓度商小于平衡常数,即
<1,解得x<3,
故答案为:x<3;
(3)已知:①CH4 (g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
②H2(g)+1/2O2(g)═H2O(l)△H2=-285.8kJ/mol
由盖斯定律,②×4-①得CO2(g)+4H2(g)═CH4 (g)+2H2O(l)△H=-252.9 kJ/mol
故答案为:CO2(g)+4H2(g)═CH4 (g)+2H2O(l)△H=-252.9 kJ/mol;
(4)负极上甲烷失电子发生氧化反应,电极反应式为:CH4+4CO32--8e-=5CO2+2H2O,正极上氧化剂得电子发生还原反应,电极反应式为:O2+2CO2+4e-=2CO32-;
电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳(CO2),所以要不断补充二氧化碳,
根据转移电子相等计算,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4体积=
=44.8L,
故答案为:CH4+4CO32--8e-=5CO2+2H2O,O2+2CO2+4e-=2CO32-;CO2;44.8.
B.由图可知4min时到达平衡,随反应进行,混合气体总质量不变,总物质的量不变,平均相对分子质量始终不变,所以不能作为平衡状态的判断依据,故B错误;
C.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,故C错误;
D.第8min时,若充入CO,反应物浓度增大,会导致v(正)>v(逆),平衡向正反应方向移动,故D正确;
故选AD;
(2)由图可知,平衡时CO的浓度为0.08mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.12 0.12 0.12 0.12
变化(mol/L):0.08 0.18 0.12 0.12
故平衡常数k=
| 0.12×0.12 |
| 0.08×0.18 |
平衡向正反应方向移动,浓度商小于平衡常数,即
| 1×x |
| 1×3 |
故答案为:x<3;
(3)已知:①CH4 (g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
②H2(g)+1/2O2(g)═H2O(l)△H2=-285.8kJ/mol
由盖斯定律,②×4-①得CO2(g)+4H2(g)═CH4 (g)+2H2O(l)△H=-252.9 kJ/mol
故答案为:CO2(g)+4H2(g)═CH4 (g)+2H2O(l)△H=-252.9 kJ/mol;
(4)负极上甲烷失电子发生氧化反应,电极反应式为:CH4+4CO32--8e-=5CO2+2H2O,正极上氧化剂得电子发生还原反应,电极反应式为:O2+2CO2+4e-=2CO32-;
电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳(CO2),所以要不断补充二氧化碳,
根据转移电子相等计算,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4体积=
| 448L×20%×4 |
| 8 |
故答案为:CH4+4CO32--8e-=5CO2+2H2O,O2+2CO2+4e-=2CO32-;CO2;44.8.
点评:本题考查较综合,涉及原电池原理、盖斯定律、化学平衡移动等知识点,难度较大,这些都是考试热点,要重点掌握.

练习册系列答案
相关题目
 O2(g)═H2O(l)△H2=-285.8kJ/mol
O2(g)═H2O(l)△H2=-285.8kJ/mol