网址:http://m.1010jiajiao.com/timu_id_68269[举报]

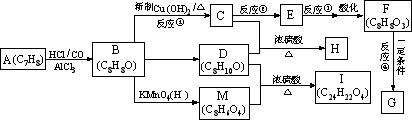
若从A出发可发生下图所示的一系列反应,其中B的分子式为C8H8O,且其苯环上的一氯取代物只有两种:

回答下列问题:
(1)写出指定物质的结构简式:F_________________,M__________________。
(2)指出反应①②的反应类型:①________________;②__________________。
(3)写出B→C反应的化学方程式:____________________________________。
(4)与C互为同分异构体且均属酯类的芳香族化合物共有6种,除![]() 这三种外,其他的同分异构体的结构简式为__________________、____________________、____________________。
这三种外,其他的同分异构体的结构简式为__________________、____________________、____________________。
| |||||||||||||||||||||||||||||||||

(1)实验室制取氨气的化学方程式为 ,工业上合成氨采取的下列措施中可用勒夏特列原理解释的是? ?(填字母)?
A.采用较高压强(20 Mpa~50 Mpa)?
B.采用500 ℃的高温?
C.用铁触媒作催化剂?
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2?
(2)适当改变如图所示的装置后,也可用来制取和收集氧气。改变的方法是: 。?
(3)实验室用浓硫酸和铜制取并收集少量的SO2气体,能否采用该装置 ? ?(填“能”或“不能”),若选填“能”,请说明理由;若选填“不能”,则怎样改变该装置后就能达到实验目的?请用文字说明 ;?
(4)取6.4 g铜片和12 mL 18.4 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,某同学根据所学的化学知识认为还有一定量的硫酸剩余。下列药品能够用来证明反应结束后烧瓶中确实有余酸的是?? ??(填字母)。?
A.铁粉 B.氯化钡溶液? C.银粉 D.碳酸氢钠溶液?
(5)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的
是 (填字母)?
A.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量?
B.将装置中产生的气体缓缓通入足量氢氧化钡溶液,反应完全后过滤、洗涤、干操、称量沉淀?
C.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后过滤、洗涤、干燥、称量沉淀?
请对不可行的方案进行分析(可以不填满)
方案序号 | 分析 | 误差(偏高或偏低) |
|
|
|
|
|
|
|
|
|
(6)请再设计其他可行的实验方案来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)。??
查看习题详情和答案>>化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。
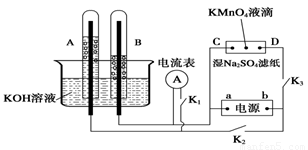
回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
(4)由表中数据判断ΔH 0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是 。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为 ;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数 (填“变大”、“变小”、或“不变”)。
查看习题详情和答案>>
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。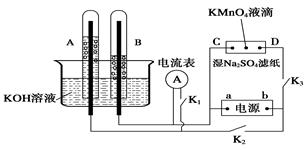
回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g) 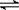 CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(4)由表中数据判断ΔH 0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是 。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为 ;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数 (填“变大”、“变小”、或“不变”)。 查看习题详情和答案>>