摘要:[生]从O Te.核电荷数依次增加.电子层数依次增多.原子半径依次增大.[转引]据氧族元素原子结构特点和递变规律.再运用元素周期律理论来推测氧族元素的性质及变化.[师]元素的化学性质主要决定于原子结构的哪些方面?[生]最外层电子数和原子半径.[追问]最外层电子数和原子半径如何决定元素的化学性质?[生]最外层电子数越多.越易得电子.表现非金属性,若原子半径越小.得电子能力越强.非金属性越强.相反.最外层电子数越少.越易失电子.表现金属性,若原子半径越大.失电子能力越强.金属性越强.[师]从氧族元素原子结构入手.请大家对其化学性质的相似相异性进行大胆的推测.[生]相似:原子最外层都有6个电子,易得2个电子,表现非金属性.
网址:http://m.1010jiajiao.com/timu_id_6800[举报]
前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为56;Y 原子的M层p轨道有3个未成对电子;Z原子的M层p轨道有4个电子;W原子的L层电子数与最外层电子数之比为8:1,其d轨道中的电子数与最外层电子数之比为5:1.
(1)W原子结构示意图为
 ,W3+的电子排布式为
,W3+的电子排布式为
(2)Y可与X形成只含一个中心原子的共价化合物a,其电子式是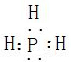
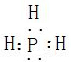 ;中心原子的杂化方式为
;中心原子的杂化方式为
(3)Z最高价氧化物的水化物结构式为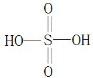
 ,碳元素与Z按1:2的原子个数比形成的b,写出一种与b互为等电子体且含有Z原子的微粒的化学式
,碳元素与Z按1:2的原子个数比形成的b,写出一种与b互为等电子体且含有Z原子的微粒的化学式
(4)Y与Z比较,电负性较大的
查看习题详情和答案>>
(1)W原子结构示意图为
1s22s22p63s23p63d3
1s22s22p63s23p63d3
.(2)Y可与X形成只含一个中心原子的共价化合物a,其电子式是
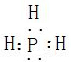
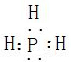
sp3
sp3
;a分子的立体构型是三角锥形
三角锥形
.(3)Z最高价氧化物的水化物结构式为


SCN-或COS
SCN-或COS
.(4)Y与Z比较,电负性较大的
S
S
,1mol单质Y4与3mol氧气在一定条件下完全反应生成1mol化合物c,一个c分子中所含有的σ键数目为12
12
.四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z原子与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1.
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,a的分子式是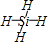
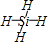 ;中心原子的杂化轨道类型分别是
;中心原子的杂化轨道类型分别是
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)
(4)Y与Z比较,电负性较大的是
(5)W的元素符号是
查看习题详情和答案>>
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,a的分子式是
CH4
CH4
,b的结构式是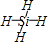
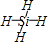
sp3
sp3
、sp3
sp3
;a分子的立体结构是正四面体
正四面体
;(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
分子
分子
晶体、原子
原子
晶体;(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)
CO2
CO2
;(4)Y与Z比较,电负性较大的是
C
C
;(5)W的元素符号是
Zn
Zn
,其+2价离子的核外电子排布式是1s22s22p63s23p63d10
1s22s22p63s23p63d10
.A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族.A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2-离子含10个电子.
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式: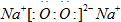
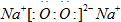 .
.
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式: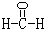
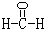 .
.
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
查看习题详情和答案>>
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式:
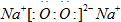
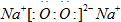
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式:
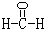
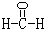
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
C2H2(g)+
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol
| 1 |
| 2 |
C2H2(g)+
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol
.| 1 |
| 2 |
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
C2H2-10e-+14OH-=2CO32-+8H2O
C2H2-10e-+14OH-=2CO32-+8H2O
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
.(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
2I-+H2O2+2H+=I2+2H2O
2I-+H2O2+2H+=I2+2H2O
.(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
.【化学一物质结构与性质】
A、B、C、D、E、F六种短周期元素,核电荷数依次增加.只有E为金属,A与F同主族,B与F同主族,B原子最外层电子数是内层电子数的2倍,D最外层有两队成对电子.E+与C3-具有相同的电子层结构.请回答下列问题:
(1)F的价电子排布为 .其B、F形成的化合物晶体类型是
(2)A、B、C、D形成的既有离子键又有共价键的化合物化学式
(3)A、C形成的分子属于 (极性或非极性)分子.该分子有 对孤对电子 个σ键,中心原子杂化方式
(4)A、E形成的化合物的电子式
(5)CA3与FA4的稳定性: ; 离子半径:E+ C3-.
查看习题详情和答案>>
A、B、C、D、E、F六种短周期元素,核电荷数依次增加.只有E为金属,A与F同主族,B与F同主族,B原子最外层电子数是内层电子数的2倍,D最外层有两队成对电子.E+与C3-具有相同的电子层结构.请回答下列问题:
(1)F的价电子排布为
(2)A、B、C、D形成的既有离子键又有共价键的化合物化学式
(3)A、C形成的分子属于
(4)A、E形成的化合物的电子式
(5)CA3与FA4的稳定性:
(2013?潍坊模拟)[化学--物质结构与性质]
A、B、C、D、E、F六种短周期元素,核电荷数依次增加.只有E为金属,A与E同主族,B与F同主族,B原子最外层电子数是内层电子数的2倍,D最外层有两对成对电子.E+与C3-具有相同的电子层结构.请回答下列问题:
(1)F的价电子排布为
(2)A、B、C、D形成的既有离子键又有共价键的化合物化学式为
(3)A、C形成的分子有
(4)稳定性:CA3
查看习题详情和答案>>
A、B、C、D、E、F六种短周期元素,核电荷数依次增加.只有E为金属,A与E同主族,B与F同主族,B原子最外层电子数是内层电子数的2倍,D最外层有两对成对电子.E+与C3-具有相同的电子层结构.请回答下列问题:
(1)F的价电子排布为
3s23p2
3s23p2
.B、F形成的化合物晶体类型是原子晶体
原子晶体
.(2)A、B、C、D形成的既有离子键又有共价键的化合物化学式为
NH4HCO3、(NH4)2CO3
NH4HCO3、(NH4)2CO3
.(3)A、C形成的分子有
1
1
对孤对电子、3
3
个σ键,中心原子杂化方式为sp3
sp3
.(4)稳定性:CA3
>
>
FA4.离子半径:E+<
<
C3-.(填“>”或“<”)