网址:http://m.1010jiajiao.com/timu_id_67374[举报]
一. 选择题:(3分×16=48分)
题 号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答 案
D
C
A
A
C
D
A
D
C
B
D
D
B
A
C
C
二.(本题共14分)
17:Ⅰ.(4分,每空1分)(1)AEF;(2)BDE ;AF;(3)F>A>C>B>E。
Ⅱ.(10分)本题答案有开放性,合理即可给分。
⑴①C(或Fe) (1分) ②
⑵CuO(Fe2O3等)(1分)
⑶①CaC2+2H2O=Ca(OH)2+C2H2↑ ;(2分) ②麦芽糖;(1分)
⑷①Na2CO3+CO2+H2O=2NaHCO3 ;(2分) ②红褐色固体。(1分)
三.(本题共20分)
18.(10分)(1)高氯酸 (1分) (2)离子键和非极性键 (1分)
(3)2I-+ClO-+H2O=I2+Cl-+2OH- (2分)
(4)2H++2e- = H2↑ (2分) 0.71g (2分)
(5)2H2(g)+O2(g)=2H2O(g) ΔH=-4QkJ/mol (2分)
19.(10分)
(1)③④⑥(2分) (2)Ca(OH)2 或 Ba(OH)2(2分)
(3)2Na + 2H2O = 2Na++ 2OH- + H2↑(2分)
(4)氧化还原:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ (2分)
非氧化还原:AlCl3 + 4NaOH = NaAlO2 +3NaCl +2H2O (2分)
或Al(OH)3 + NaOH = NaAlO2 + 2H2O
或Al2O3 + 2NaOH = 2NaAlO2 + H2O
(其它合理答案酌情给分)
四. (本题共9分) (每空1分)
20.Ⅰ(1)关闭分液漏斗的活塞,在B中加水至浸没长导管口,用酒精灯微热(或用手热),长导管口有气泡冒出,停止加热,长导管内形成一段水柱,说明装置的气密性良好。
(2)圆底烧瓶; 常温下,Fe在浓硫酸中钝化,碳不与浓硫酸反应
(3)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O; 品红溶液逐渐褪色
CO2↑+2SO2↑+2H2O; 品红溶液逐渐褪色
(4)2Fe3++Fe=3Fe2+(或Fe+2H+=Fe2++H2↑)
(5)铁碳在酸溶液中形成原电池
Ⅱ(6) (7)C
(7)C
五.(本题共9分) 21.
 短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.请回答下列问题:
(1)C的最高价氧化物对应水化物电子式为
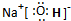
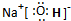
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为
(3)用石墨电极电解CD的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体的物质的量为
(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是(填序号)
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(5)25℃时,将pH=4.00的A元素与D元素形成化合物AD的水溶液稀释1.00×103倍,则稀释后溶液中各离子浓度必遵循的定量等式关系式是
(6)将一定量的D单质通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是
(1)D的最高价氧化物对应水化物名称为
(2)C2B2的电子式为


(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应离子方程式为
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为
| ||
| ||
若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为
(5)实验室欲检验CD溶液中所含的D-,操作方法和现象为
(1)化合物C2B2中含有的化学键类型为
(2)化合物CDB是家用消毒剂的主要成分,其水溶液显碱性.显碱性的原因用离子方程式表示为
(3)往CD溶液中滴加硝酸银溶液生成白色沉淀后,再滴加碘化钠溶液,可观察到的现象是
(1)D的最高价氧化物对应的水化物名称为_______________。
(2)G为由A、B、C三种元素组成的化合物,其电子式为_______________,其中含有的化学键类型为_______________。
(3)A单质与D单质反应可生成化合物E,E分子中的电子数与A元素和B元素组成的F分子中的电子数相等。写出F+D单质→E的化学方程式:_______________。
(4)由上述四种元素中的三种组成某种盐,其水溶液显碱性,常用作家用消毒液。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为_________________________。
(5)用石墨电极电解质量分数为5.2%的G溶液1 L(密度为