网址:http://m.1010jiajiao.com/timu_id_6523[举报]
(一)选择题
1.C2.C3.A4.B5.C6.B7.D8.A、B9.D10.AB11.B、C12.C13.D14.C15.C16.C17.D18.B19.A、D20.A21.B22.D23.B24.C25.D26.C27.B28.D29.A、D30.B
(二)非选择题
1.有关反应为
Fe+4HNO3Fe(NO3)3+NO+2H2O……(1)
Fe(NO3)3Fe2O3+3NO2+O2……(2)
3NO2+O2+H2O3HNO3……(3)
NO+O2+H2OHNO3……(4)
由逆向推,反应(4)中n(NO)=这正好是反应(1)中消耗的n(Fe)。故耗铁的质量m(Fe)=0.04mol×56g/mol=2.24gA中溶质为(3)、(4)反应中生成的HNO3,根据氮原子守恒规则,正好是反应(1)中消耗的HNO3,所以A中HNO3质量:m(HNO3)=0.04mol×4×63g/mol=8.82g答(略)
2.NH3?H2O+SO2=NH4++HSO3―或2NH3?H2O+SO2=2HN4++SO+H2O
2NO2+2OH―=NO3―+NO2―+H2O
CaCO3+2H+=Ca2++H2O+CO2?
3.解析题目给予的条件较多,海水中有D物质存在,且A、B元素均为常见的元素,可推知D可能为MgCl2。并由此推出A单质是Ba,B单质是Mg,X为Cl2或HCl,E为BaCl2。
答案:(1)Cl2或HCl
(2)MgCl2+Ba(OH2)BaCl2+Mg(OH)↓(3)Ba2++SOBaSO4↓
4.P4、X:P2O5Y:HPOZ:H3PO4
5.(1)S~CaSO4?2H2O
1mol172g
x
x=76780g=76.78kg
(2)若溶液中溶质全为Na2SO3,则Na+=2mol?L-1×0.2L=0.4mol,Na2SO3质量为0.2mol×126g/mol=25.2g<33.4g;
若溶质是NaHSO3,则质量是:
0.4mol×104g/mol=41.6g>33.4g
所以,33.4g溶质是Na2SO3和NaHSO3的混合物。
设Na2SO3的物质的量为x,NaHSO3为y
解得:x=0.1mol,y=0.2mol
6.(1)6HCl+KClO3KCl+3Cl2+3H2O(2)0.5mol电子(3)73.3
7.①以防止试管C内Na2O2和外界相通时发生吸潮现象②浓H2SO4Na2O2与干燥的CO2不反应③带火星的小木条在试管B的液面上剧烈燃烧,同时黄色粉末变成白色粉末④2Na2O2+2C18O2+2H=2Na2C18O3+2H2O+O2?
8.(1)从周期表位置上下关系看,金属性Mg>Li,从周期表位置左右关系看,金属性Li>Mg,所以处在以上图对角关系的两个元素,化学性质往往相似。
(2)两性H2BeO2+2OH―BeO+2H2O,Be(OH)2+2H+Be2++2H2O(3)原子
9.(1)球碳分子C60?(2)星际中存在的应是球碳分子C60,火山口发现的应是金刚石。
10.(1)含Ba2+、Ca2+离子中的一种或两种,因BaSO4难溶,CaSO4微溶。(2)Fe(OH)3(3)2AlO―2+CO2+3H2O2Al(OH)3↓+CO或AlO―2+CO2+2H2OAl(OH)3↓+HCO―3
11.(1)D,3H2O2+Cr2(SO4)3+10KOH2K2CrO4+3K2SO4+8H2O(2)C(3)A
12.(1)Cu+H2SO4(浓)CuSO4+SO2↑+H2O
(2)4FeS2+11O22Fe2O3+8SO2
(3)H2S+H2SO4(浓)S↓+SO2↑+H2O
(4)Na2SO3+H2SO4Na2SO4+SO2↑+H2O
13.“不另加固体或液体物质”说明可以通入气体试剂。依题意通NH3可使溶液中的Al3+沉淀;通CO2气可使溶液中的AlO―2沉淀;也可用Al3+和AlO―2在溶液中相混合产生沉淀的方法。
(1)设往A溶液中至少通入xmolNH3,则
Al3++3NH3+3H2OAl(OH)3?+3NH+4
11
axx=3amol
(2)设往B溶液中至少通入ymolCO2,则
2AlO―2+CO2+3H2O2Al(OH)3+CO
21
byy=0.5bmol
(3)将A溶液与B溶液混合,则
Al3++3AlO―2+6H2O4Al(OH)3?
13
ab
讨论:①若b=3a,则混合后两溶液中的Al元素正好全部转化为沉淀;
②若b<3a,则只有AlO―2完全转化。
Al3++3AlO―2+6H2O4Al(OH)2?
13
b
则剩余Al3+(a-)mol,还需要通入NH3为3(a-)=(3a-b)mol。
③若b>3a,则只有Al3+完全转化。
Al3++3AO―2+6H2O4Al(OH)3
13
a3a
则剩余AlO―2(b-3a)mol,还需通入CO2气体为mol。
14.(1)A、C、D(2)Cu++NO―2+2H+Cu2++NO↑+H2O
(3)3NONO2+N2O
(4)生成的NO2又发生如下反应:2NO2N2O4,而使压力略小于原压力的
15.(1)稀,a、c(2)a、c(3)b,Fe(OH)3,Cu(OH)2
16.解析(1)从图中可以看出,在由硅氧四面体形成的环上,每个硅原子保留了两个没有被共用的氧原子,另外还有两个氧原子分别在相邻的左右两个硅氧四面体共用,因此在每个硅氧四面体内占有的氧原子数为:
即,如果硅原子的数目为n,则氧原子的数目为3n.构成硅氧四面体内的硅原子呈+4价,氧原子呈-2价,据此可计算出酸根的化合价,从而写出通式(2)将n=6代入通式,可知绿柱石的酸根为(Si6O18)12-,因此两种金属的化合价之和应为+12。设绿柱石化学式为BexAlySi6O18,元素Be为+2价,元素Al为+3价,由此可得2x+3y=12,经讨论解得x=3,y=2是合理答案,这样可确定绿柱石的化学式为Be3Al2Si6O18,最后可写出氧化物形式:3BeO?Al2O3?6SiO2.
17.(1)孔雀石CuCO3?Cu(OH)2石青2CuCO3?Cu(OH)2
(2)化学组成:CuCO3?Cu(OH)2与2CuCO3?Cu(OH)2混合物
(3)36g
(4)A=124
18.(1)(略)(2)先通NH3,因其溶解度远大于CO2.在通CO2时发生NH3+CO2+H2O=NH4HCO3,使[HCO―3]大增,而NaHCO3溶解度不是很大,故析出。若反之由于CO2溶解度小,再通NH3时,不能使[HCO―3]大增,故不析出。若同时通气则会浪费CO2.
19.解析Fe3+对Zn、Fe、Cu均显氧化性,故有Fe3+就无金属残留,溶液中离子为Zn2+、Fe2+、Cu2+、Fe3+。溶液显蓝色,有Cu2+,则Fe、Zn不能存在,故②中Cu可能剩余,溶液中离子为Cu2+、Fe2+、Zn2+。③有Fe则无Cu2+、Fe3+,Fe质量不变说明Fe3+恰好和Zn反应掉(Fe3+先与还原能力强的Zn反应),否则存在如有Zn存在则Zn+Fe2+Fe,会使Fe质量增加,所以固体是Cu、Fe混合物。因Zn+2Fe3+Zn2++2Fe2+,故反应后Cu∶Fe∶Fe2+∶Zn2+∶Cl―=1∶1∶2∶1∶6。④还有Zn剩余,则溶液里无Fe3+、Fe2+、Cu2+只有Zn2+。Cu、Fe均未消耗,相反Fe质量还要增加。
20.(1)FeS、FeS2(2)(3)略
21.E:C;G:O;D:Fe;A:Kx=3;y=1;z=3K3Fe(C2O4)3
22.①②④③⑥(2)K2CO3溶液(3)不能,KOH溶液,AgNO3溶液,小于
23.C2Cl?5F,C2H2F4
24.(1)1,0<x<w(2)2,x≥w(3)
25.(1)甲:x表示Cl2的物质的量
乙:x表示原有Cl2的体积
丙:x表示被氧化的NH3的物质的量
丁:x表示原混合气中的Cl2的体积分数
(2)0.34g
26.(1)a=,b==1.306
(2)m1(H2O)=20g?mol-1?n1(SO3)
m2(H2O)=13.8g?mol-1?n2(SO3)
(3)
(4)m总(H2O)=
27.(SinO3n+1)(2n+2)-
28.(1)BH―4+2H2O=BO―2+4H2↑(2)3BH―4+8Au3++24OH―=3BO―2+8Au+18H2O
29.(1)C+CO22CO(2)FeO和Fe,CO2(3)C和Fe,CO(4)1/2<n<1(5)n=2/3
30.(1)B+3HNO3H3BO3+3NO2
(2)
(3)B2H6
31.(1)Cu2O+Fe2(SO4)3+H2SO42CuSO4+2FeSO4+H2O
(2)10FeSO4+2KMnO4+8H2SO45Fe2(SO4)3+2MnSO4+K2SO4+8H2O
(3)Cu2O~Fe2(SO4)3~2FeSO4~KMnO4
mCu2o=
Cu2O%=×100%=72%
32.(1)①4Al+3O22Al2O3+Q
②2NH4ClO42O2↑+N2↑+Cl2↑+4H2O↑
(2)1mol高氯酸铵分解所产生的气体有4mol.
33.加液氨后HClO与NH3反应转化为较稳定的NH2Cl,可在水中存在较长时间,而且随着HClO的开始消耗,上述平衡向左移动,产生HClO,又起杀菌作用。
34.(1)3Br2+6OH―BrO―3+5Br―+3H2O
(2)BrO―3+5Br―+6H+3Br2+3H2O
35.(1)Be+2OH―BeO+H2↑
(2)NaOH溶液,Be(OH)2+2OH―+2H2O
(3)共价化合物,∶Cl∶Be∶∶,Be2++2H2OBe(OH)2+2H+
铁及其化合物在生产和生活中有着广泛的应用。某实验小组设计了如下实验探究
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00
mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0200
mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO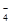 还原成Mn2+。
还原成Mn2+。
重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
查看习题详情和答案>>
铁及其化合物在生产和生活中有着广泛的应用。某实验小组设计了如下实验探究
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0200 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO 还原成Mn2+。
还原成Mn2+。
重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO
 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。步骤三:用0.0200 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO
 还原成Mn2+。
还原成Mn2+。重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量的影响如下图:
(1)温度对该反应的反应速率和平衡移动的影响是
(2)其他条件不变,请在图2中画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线.
(3)已知:在700℃,1MPa时,1mol CH4与一定量H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,对应的热量变化为aKJ,则这6分钟的平均反应速率v(H2)为
(4)CaCO3是一种难溶物,其Ksp=2.8×10-9.现将 amol/L的CaCl2溶液与2.0×10-4mol/L Na2CO3溶液等体积混合(假设溶液体积可直接相加),若要生成CaCO3沉淀,则a的最小值为
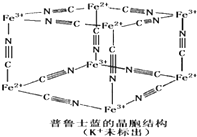 (1)铁及铁的化合物在生产、生活中有着重要的用途.
(1)铁及铁的化合物在生产、生活中有着重要的用途.①.聚合硫酸铁(简称PFS)[Fe (OH)n(SO4) (3-n)/2]m(m是聚合度),常用于在水体中形成絮状物,以吸附重金属离子.则其中铁元素的价态为
②.六氰合铁酸钾K3[Fe(CN)6]可用于检验Fe2+,出现特殊的蓝色沉淀.CN-中碳原子的杂化方式为
③.三氯化铁在常温下为固体,熔点304℃,沸点316℃,300℃以上可升华,易溶于水,也易溶于乙醚,丙酮等有机溶剂.据此推断三氯化铁晶体为
④.普鲁士蓝是一种配合物,可用作染料,它的结构单元如右图所示,普鲁士蓝中n(CN一):n(K+):n(Fe3+):n(Fe2+)=
(2)水和氨有相似之处,如:H2O+H+=H3O+、NH3+H+=NH4+.
①NH4+的键角
②冰和固态氨的晶胞都不属于分子最密堆积,原因是