题目内容
 (1)铁及铁的化合物在生产、生活中有着重要的用途.
(1)铁及铁的化合物在生产、生活中有着重要的用途.①.聚合硫酸铁(简称PFS)[Fe (OH)n(SO4) (3-n)/2]m(m是聚合度),常用于在水体中形成絮状物,以吸附重金属离子.则其中铁元素的价态为
②.六氰合铁酸钾K3[Fe(CN)6]可用于检验Fe2+,出现特殊的蓝色沉淀.CN-中碳原子的杂化方式为
③.三氯化铁在常温下为固体,熔点304℃,沸点316℃,300℃以上可升华,易溶于水,也易溶于乙醚,丙酮等有机溶剂.据此推断三氯化铁晶体为
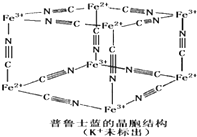
④.普鲁士蓝是一种配合物,可用作染料,它的结构单元如右图所示,普鲁士蓝中n(CN一):n(K+):n(Fe3+):n(Fe2+)=
(2)水和氨有相似之处,如:H2O+H+=H3O+、NH3+H+=NH4+.
①NH4+的键角
②冰和固态氨的晶胞都不属于分子最密堆积,原因是
分析:(1)①根据正负化合价的代数和为0计算铁元素的化合价;根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型;
②根据C原子价层电子对个数确定杂化方式;等电子体指原子数相等价电子总数相等的微粒;等电子体的结构相似,故O22+的电子式与CN一的电子式相似,含有2个π键;
③根据分子晶体的熔点、沸点低来分析;
④利用均摊法计算以及电荷守恒来分析;
(2)①NH4+中N原子,H3O+的键中O原子都采取SP3,轨道构型为正四面体,但H3O+中含有1对孤电子对,使得H3O+的键角偏小;
②氢键具有饱和性和方向性.
②根据C原子价层电子对个数确定杂化方式;等电子体指原子数相等价电子总数相等的微粒;等电子体的结构相似,故O22+的电子式与CN一的电子式相似,含有2个π键;
③根据分子晶体的熔点、沸点低来分析;
④利用均摊法计算以及电荷守恒来分析;
(2)①NH4+中N原子,H3O+的键中O原子都采取SP3,轨道构型为正四面体,但H3O+中含有1对孤电子对,使得H3O+的键角偏小;
②氢键具有饱和性和方向性.
解答:解:(1)①[Fe2(OH)n(SO4)3-n/2]m中n小于5,且
为正整数,且化合物中各元素的化合价代数和为0,铁的化合价为正整数,所以n=2,铁元素的化合价为+3;
SO42-中心原子含有4个σ键,孤电子对数=
×(6+2-4×2)=0,所以其空间构型为正四面体结构,
故答案为:+3、正四面体;
②CN-中C原子价层电子对个数=1+
(4+1-1×3)=2,所以采取sp杂化;
CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为O22+,根据等电子体原理可知,O22+的电子式 ,
,
故答案为:sp;O22+; ;
;
③三氯化铁,其熔点:282℃,沸点315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,符合分子晶体的特征,故为三氯化铁分子晶体,
故答案为:分子;
④Fe3+离子的个数为:4×
=
;Fe2+离子的个数为:4×
=
;CN-离子的个数为:12×
=3,
根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN一),得N(K+)=
,
普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)=1:1:1:6,
故答案为:1:1:1:6;
(2)①NH4+中N原子,H3O+的键中O原子都采取SP3,轨道构型为正四面体,但H3O+中含有1对孤电子对,使得H3O+的键角偏小,小于109.5°,
故答案为:大于;
②冰和固态氨中都含有氢键,氢键具有饱和性和方向性,所以冰和固态氨的晶胞都不属于分子最密堆积,故答案为:氢键具有饱和性和方向性.
| n |
| 2 |
SO42-中心原子含有4个σ键,孤电子对数=
| 1 |
| 2 |
故答案为:+3、正四面体;
②CN-中C原子价层电子对个数=1+
| 1 |
| 2 |
CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为O22+,根据等电子体原理可知,O22+的电子式
 ,
,故答案为:sp;O22+;
 ;
;③三氯化铁,其熔点:282℃,沸点315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,符合分子晶体的特征,故为三氯化铁分子晶体,
故答案为:分子;
④Fe3+离子的个数为:4×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN一),得N(K+)=
| 1 |
| 2 |
普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)=1:1:1:6,
故答案为:1:1:1:6;
(2)①NH4+中N原子,H3O+的键中O原子都采取SP3,轨道构型为正四面体,但H3O+中含有1对孤电子对,使得H3O+的键角偏小,小于109.5°,
故答案为:大于;
②冰和固态氨中都含有氢键,氢键具有饱和性和方向性,所以冰和固态氨的晶胞都不属于分子最密堆积,故答案为:氢键具有饱和性和方向性.
点评:本题主要考查元素化合价、电子排布式、键角、晶体性质、晶胞计算、等电子体的运用等,是对知识与能力综合考查,难度较大.

练习册系列答案
相关题目

 Pb + PbO2 + 2H2SO4
Pb + PbO2 + 2H2SO4 Pb + PbO2 + 2H2SO4
Pb + PbO2 + 2H2SO4