摘要:如:写成 [CuCl2]-(aq)CuCl(s) + Cl-(aq)或[CuCl3]3-(aq)CuCl(s) + 2Cl-(aq).4Cu++O2+4H+===4Cu2++2H2O
网址:http://m.1010jiajiao.com/timu_id_58288[举报]
(I)多项选择题
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).则下列有关Y的意义的叙述正确的是

A.a图表示第三周期元素的原子半径(稀有气体除外)
B.b图表示ⅡA族元素的最外层电子数
C.c图表示第二周期元素的电负性(稀有气体除外)
D.d图表示第三周期元素的第一电离能(稀有气体除外)
E.e图表示第ⅦA族元素氢化物的沸点
(II)
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如下:

(1)写出铜原子价层电子的轨道排布式
 ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有
,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有
(2)由上图可知:胆矾中存在的作用力有
a.离子键 b.配位键 c.氢键 d.极性键 e.非极性键
(3)往浓CuSO4溶液中加入过量较浓的NH3?H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的C2H5OH并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4?H2O晶体.实验中所加C2H5OH的作用是
(4)已知Cu(NH3)42+呈平面正方形结构,则Cu(NH3)4SO4?H2O晶体中呈正四面体的粒子是
(5)如将深蓝色溶液加热,可能得到什么结果?
查看习题详情和答案>>
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).则下列有关Y的意义的叙述正确的是
ABC
ABC

A.a图表示第三周期元素的原子半径(稀有气体除外)
B.b图表示ⅡA族元素的最外层电子数
C.c图表示第二周期元素的电负性(稀有气体除外)
D.d图表示第三周期元素的第一电离能(稀有气体除外)
E.e图表示第ⅦA族元素氢化物的沸点
(II)
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如下:

(1)写出铜原子价层电子的轨道排布式


K、Cr
K、Cr
(填元素符号).(2)由上图可知:胆矾中存在的作用力有
abcd
abcd
a.离子键 b.配位键 c.氢键 d.极性键 e.非极性键
(3)往浓CuSO4溶液中加入过量较浓的NH3?H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的C2H5OH并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4?H2O晶体.实验中所加C2H5OH的作用是
加C2H5OH,减小“溶剂”(C2H5OH和H2O)的极性,降低离子化合物Cu(NH3)4SO4?H2O的溶解度,便于析出
加C2H5OH,减小“溶剂”(C2H5OH和H2O)的极性,降低离子化合物Cu(NH3)4SO4?H2O的溶解度,便于析出
.(4)已知Cu(NH3)42+呈平面正方形结构,则Cu(NH3)4SO4?H2O晶体中呈正四面体的粒子是
SO42-
SO42-
,杂化轨道类型是sp3的原子有N、S、O
N、S、O
.(5)如将深蓝色溶液加热,可能得到什么结果?
加热,NH3挥发,生成Cu(OH)2蓝色沉淀和(NH4)2SO4
加热,NH3挥发,生成Cu(OH)2蓝色沉淀和(NH4)2SO4
.金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用.完成下列填空:
(1)铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子.
(2)镓(Ga)与铝同族.写出镓的氯化物和氨水反应的化学方程式 .
(3)硅与铝同周期.SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O?CaO?6SiO2.盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 .长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同.由钠长石化学式NaAlSi3O8可推知钙长石的化学式为 .
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法.如:2Al+4BaO
3Ba↑+BaO?Al2O3.常温下Al的金属性比Ba的金属性 (选填“强”“弱”).利用上述方法可制取Ba的主要原因是 .
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO?Al2O3比Al2O3稳定 d.Ba的沸点比Al的低.
查看习题详情和答案>>
(1)铝原子核外电子云有
(2)镓(Ga)与铝同族.写出镓的氯化物和氨水反应的化学方程式
(3)硅与铝同周期.SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O?CaO?6SiO2.盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法.如:2Al+4BaO
| 高温 |
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO?Al2O3比Al2O3稳定 d.Ba的沸点比Al的低.
(2010?南通模拟)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)基态溴原子的电子排布式为
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为
(5)气态氟化氢中存在二聚分子(HF)2,这是由于
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为
查看习题详情和答案>>
(1)基态溴原子的电子排布式为
[Ar]3d104s24p5
[Ar]3d104s24p5
.(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为
BrI>ICl>Cl2
BrI>ICl>Cl2
.(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为
RbCl
RbCl
.(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为
V形
V形
.(5)气态氟化氢中存在二聚分子(HF)2,这是由于
HF分子间形成氢键
HF分子间形成氢键
.(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为
①②③
①②③
(填序号)(2013?泰安三模)[化学--物质结构与性质]
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.

(1)Mn2+在基态时,核外电子排布式为
(2)硫化锌的晶胞结构如图1所示,则每个晶胞中含S2-的数目为
(3)蒽(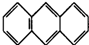 ,平面结构)属于
,平面结构)属于
(4)8一羟基喹啉铝具有较高的发光效率.8一羟基喹啉铝的分子结构如图2所示,其分子中存在的相互作用力有
(5)已知铜元素能形成多种化合物.
①CuSO4?5H2O也可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图3所示.下列说法正确的是
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCO-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95.已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为-2价、Cu为+2价和+3价.则该化合物中+2价Cu和+3价Cu的原子个数之比为
查看习题详情和答案>>
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.

(1)Mn2+在基态时,核外电子排布式为
[Ar]3d5
[Ar]3d5
.(2)硫化锌的晶胞结构如图1所示,则每个晶胞中含S2-的数目为
4
4
个.(3)蒽(
 ,平面结构)属于
,平面结构)属于非极性
非极性
(填“极性”或“非极性”)分子.(4)8一羟基喹啉铝具有较高的发光效率.8一羟基喹啉铝的分子结构如图2所示,其分子中存在的相互作用力有
ABE
ABE
(填字母).A.极性键 B.非极性键 C.金属键 D.氢键 E.配位键(5)已知铜元素能形成多种化合物.
①CuSO4?5H2O也可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图3所示.下列说法正确的是
BD
BD
(填字母).A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCO-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95.已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为-2价、Cu为+2价和+3价.则该化合物中+2价Cu和+3价Cu的原子个数之比为
7:3
7:3
.(2009?深圳二模)对钢铁零件进行表面发蓝处理可大大增强抗蚀能力.其主要工艺如下:
(1)预处理:把钢铁零件分别浸入105℃的1.0mol/L Na2CO3溶液→20℃水→20℃30%盐酸→20℃水.其中酸浸的目的是
(2)氧化发蓝处理:把预处理后钢铁零件浸入140℃1L发蓝液中(15.6mol/L NaOH、3.26mol/L NaNO2),发生如下反应:
3Fe+NaNO2+5NaOH=3Na2FeO2+NH3+H2O;
3Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3+7NaOH
Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
总反应可以表示为
(3)氧化膜致密性检查:①浓硝酸、硫酸、③氯水、④硫酸铜溶液、⑤KSCN溶液、⑥NaOH溶液.请选用上述合适试剂设计方案,检查发蓝零件的氧化膜致密性是否合格.填写下表:
(4)发蓝液废水中含有致癌物NaNO2,可以用氧化剂如漂白粉转变成硝酸钠,写出离子方程式:
查看习题详情和答案>>
(1)预处理:把钢铁零件分别浸入105℃的1.0mol/L Na2CO3溶液→20℃水→20℃30%盐酸→20℃水.其中酸浸的目的是
除去零件表面的铁锈
除去零件表面的铁锈
.(2)氧化发蓝处理:把预处理后钢铁零件浸入140℃1L发蓝液中(15.6mol/L NaOH、3.26mol/L NaNO2),发生如下反应:
3Fe+NaNO2+5NaOH=3Na2FeO2+NH3+H2O;
3Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3+7NaOH
Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
总反应可以表示为
9Fe+4NaNO2+8H2O=3Fe3O4+4NH3+4NaOH
9Fe+4NaNO2+8H2O=3Fe3O4+4NH3+4NaOH
.测得发蓝处理残留液NaOH浓度为16.0mol.L-1,则反应中转移电子为2.4
2.4
mol(假设体积不变)(3)氧化膜致密性检查:①浓硝酸、硫酸、③氯水、④硫酸铜溶液、⑤KSCN溶液、⑥NaOH溶液.请选用上述合适试剂设计方案,检查发蓝零件的氧化膜致密性是否合格.填写下表:
| 实验步骤 | 现象 | 结论 |
将零件浸没在硫酸铜溶液中 将零件浸没在硫酸铜溶液中 |
零件表面出现红色斑点 零件表面出现红色斑点 |
产品不合格 |
NO2-+ClO-=NO3-+Cl-
NO2-+ClO-=NO3-+Cl-
.