摘要:① R-CHO + 2Cu(OH)2Cu2O + R-COOH + 2H2O② Cu2+ + 4I-=2CuI↓+ I2③ 氯化亚铜在不同浓度的KCl溶液中可形成[CuCl2]-.[CuCl3]2- .[CuCl4]3-等离子.且它们在溶液中均为无色. 实验过程:甲:将锌放入浓盐酸中.反应速率较快,乙:将实验过程记录下来.交流并讨论: 记录卡片 NO:2008-SY-609主题:Zn.Cu+浓盐酸⑴将锌片与铜片贴在一起.一同投入浓盐酸中.反应快速放出气体.⑵当锌完全溶解后.将溶液加热.铜片逐渐溶解.又产生气体且产生的气体总体积明显比甲多.得到无色溶液.⑶将上述反应后的溶液.隔绝空气.加入适量水.出现白色沉淀. 根据上述资料与两位同学的交流材料请你回答下列列问题(1)乙反应速率明显比甲快.原因是: .(2)根据铜位于金属活动顺序表氢之后.与盐酸不反应.对乙产生的气体体积比甲大的事实.作出如下推断:
网址:http://m.1010jiajiao.com/timu_id_58285[举报]
已知信息1:含有活泼氢的有机物与胺和甲醛发生三分子之间的缩合反应,放出水分子,称为Mannich反应.
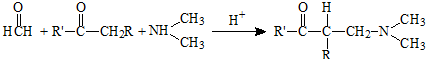
已知信息2:
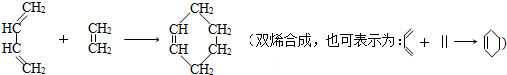
已知信息3:
①室温下,一卤代烷(RX)与金属镁在干燥乙醚中作用,生成有机镁化合物:
RX+Mg
RMgX,这种产物叫格氏试剂.它可以与醛、酮、酯发生反应,可用来合成烷烃、烯烃、醇、醛、酮、羧酸等一系列化合物.如:
R′-CHO+RMgX→R′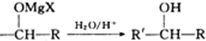 +Mg(OH)X
+Mg(OH)X
某种抗痉挛药物E的合成路线如下: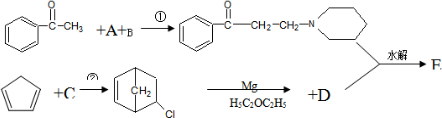
上述反应部分产物已略去,根据所给信息,回答下列问题
(1)已知A的核磁共振氢谱只有一个吸收峰,写出下列物质的结构简式
A B E
(2)写出反应②的化学方程式 反应类型
(3)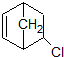 中手性碳原子数为 个
中手性碳原子数为 个
(4)以乙烯为基本原料合成3-甲基-3-戊醇(无机原料自选) .
查看习题详情和答案>>
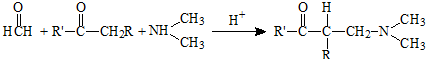
已知信息2:
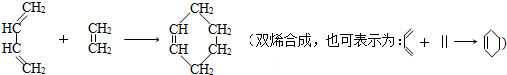
已知信息3:
①室温下,一卤代烷(RX)与金属镁在干燥乙醚中作用,生成有机镁化合物:
RX+Mg
| 乙醚 | 室温 |
R′-CHO+RMgX→R′
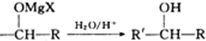 +Mg(OH)X
+Mg(OH)X某种抗痉挛药物E的合成路线如下:

上述反应部分产物已略去,根据所给信息,回答下列问题
(1)已知A的核磁共振氢谱只有一个吸收峰,写出下列物质的结构简式
A
(2)写出反应②的化学方程式
(3)
 中手性碳原子数为
中手性碳原子数为(4)以乙烯为基本原料合成3-甲基-3-戊醇(无机原料自选)
【化学--选修有机化学基础】
近日,各地媒体纷纷报道了有“火锅红”、“火锅飘香剂”、“辣椒精”等造就的“化学火锅”的新闻,食品添加剂的使用引起了人们的注意,亟待规范.
乙偶姻是一种应用较广泛的香料.乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1,乙偶姻中含有碳氧双键.与乙偶姻有关的反应如下:
HO-RCH-CHR’-OH
RCHO+R’CHO
已知:
(1)乙偶姻的分子式为
(2)反应①、②的反应类型为:①
(3)D→E反应的化学方程式为
B→C反应的化学方程式为
(4)X是乙偶姻的同分异构体,属于酯类,写出2种X可能的结构简式:

查看习题详情和答案>>
近日,各地媒体纷纷报道了有“火锅红”、“火锅飘香剂”、“辣椒精”等造就的“化学火锅”的新闻,食品添加剂的使用引起了人们的注意,亟待规范.
乙偶姻是一种应用较广泛的香料.乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1,乙偶姻中含有碳氧双键.与乙偶姻有关的反应如下:
HO-RCH-CHR’-OH
| HIO4 |
| △ |
已知:
(1)乙偶姻的分子式为
C4H8O2
C4H8O2
,G的结构简式为CH3CH2OH
CH3CH2OH
.(2)反应①、②的反应类型为:①
消去反应
消去反应
、②加聚反应
加聚反应
.(3)D→E反应的化学方程式为
CH3CH(OH)CH(OH)CH3+2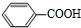
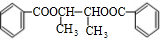 +2H2O
+2H2O

| 浓硫酸 |
| △ |
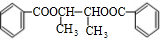 +2H2O
+2H2OCH3CH(OH)CH(OH)CH3+2
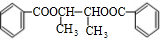 +2H2O
+2H2O
.
| 浓硫酸 |
| △ |
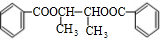 +2H2O
+2H2OB→C反应的化学方程式为
n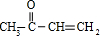
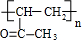
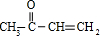
| 一定条件 |
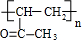
n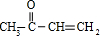
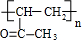
.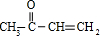
| 一定条件 |
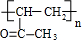
(4)X是乙偶姻的同分异构体,属于酯类,写出2种X可能的结构简式:
HCOOCH2CH2CH3
HCOOCH2CH2CH3
,CH3COOCH2CH3、
CH3COOCH2CH3、

[化学--选修5:有机化学基础]
从樟科植物枝叶提取的精油中含有甲、乙、丙三种成分(图1和表丙):
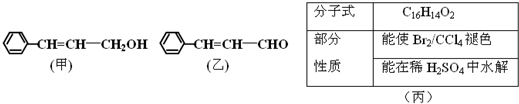
(1)①甲和乙中含氧官能团的名称分别为 和 .
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式 .
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物):
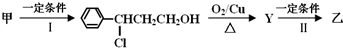
反应Ⅰ的反应类型为 ,Y的结构简式 .
(3)已知:RCH=CHR′
RCHO+R′CHO由乙制取丙的路线如下(A-D均为有机物):
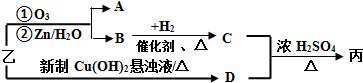
①由乙转化为D的化学方程式 .
②C的结构简式 .
查看习题详情和答案>>
从樟科植物枝叶提取的精油中含有甲、乙、丙三种成分(图1和表丙):

(1)①甲和乙中含氧官能团的名称分别为
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物):
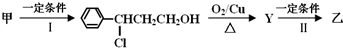
反应Ⅰ的反应类型为
(3)已知:RCH=CHR′
| ①O3 | ②Zn/H2O |

①由乙转化为D的化学方程式
②C的结构简式
(2013?聊城一模)【化学--有机化学基础】
已知:醛分子间可相互发生缩合反应,这是使碳链增长的重要方式之一,例如:
R-CHO+CH3CHO
R-CH=CH-CHO+H2O
有机物E可分别由有机物A和C通过下列两种方法制备:

(1)有机物D的结构简式为
 ,反应②的反应类型是
,反应②的反应类型是
(2)写出B与NaOH水溶液共热的化学方程式 +NaOH
+NaOH
 +NaBr
+NaBr +NaOH
+NaOH
 +NaBr.
+NaBr.
(3)E有多种同分异构体,其中与E具有相同官能团,且属于芳香族化合物的物质有
(4)乙基香草醛 是有机物A的同分异构体,下列说法错误的是
是有机物A的同分异构体,下列说法错误的是
a.乙基香草醛能与NaHCO3溶液反应
b.乙基香草醛能与浓溴水发生取代反应
c.1mol乙基香草醛最多能与3molH2发生加成反应
d.乙基香草醛和有机物A能用FeCl3溶液来鉴别.
查看习题详情和答案>>
已知:醛分子间可相互发生缩合反应,这是使碳链增长的重要方式之一,例如:
R-CHO+CH3CHO
| 一定条件 |
有机物E可分别由有机物A和C通过下列两种方法制备:

(1)有机物D的结构简式为


消去反应
消去反应
.(2)写出B与NaOH水溶液共热的化学方程式
 +NaOH
+NaOH| H2O |
| △ |
 +NaBr
+NaBr +NaOH
+NaOH| H2O |
| △ |
 +NaBr
+NaBr(3)E有多种同分异构体,其中与E具有相同官能团,且属于芳香族化合物的物质有
4
4
种.(4)乙基香草醛
 是有机物A的同分异构体,下列说法错误的是
是有机物A的同分异构体,下列说法错误的是ac
ac
.a.乙基香草醛能与NaHCO3溶液反应
b.乙基香草醛能与浓溴水发生取代反应
c.1mol乙基香草醛最多能与3molH2发生加成反应
d.乙基香草醛和有机物A能用FeCl3溶液来鉴别.
(2011?常州三模)药物E具有抗癌抑菌功效,其合成路线如下:(B、D分子中未参加反应的部分省略)
(1)很多药物分子有手性碳而具有旋光性,A分子中有
(2)C的结构简式为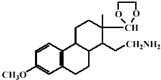
 ,E的结构简式为
,E的结构简式为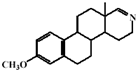
 .
.
(3)设计反应①的目的是
(4)A与银氨溶液反应的化学方程式为(A以R-CHO表示)
(5)阅读以下信息,依据以上流程图和所给信息,以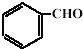 和
和 为
为
原料设计合成氨基酸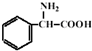 的路线.已知:
的路线.已知: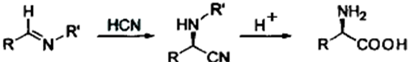
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A
B
C…→H.
 .
.
查看习题详情和答案>>

(1)很多药物分子有手性碳而具有旋光性,A分子中有
4
4
个手性碳原子.(2)C的结构简式为




(3)设计反应①的目的是
保护醛基不被还原
保护醛基不被还原
.(4)A与银氨溶液反应的化学方程式为(A以R-CHO表示)
RCHO+2Ag(NH3)2++2OH-
RCOO-+NH4++2Ag↓+3NH3+H2O
| △ |
RCHO+2Ag(NH3)2++2OH-
RCOO-+NH4++2Ag↓+3NH3+H2O
.| △ |
(5)阅读以下信息,依据以上流程图和所给信息,以
 和
和 为
为原料设计合成氨基酸
 的路线.已知:
的路线.已知:
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A
| 反应物 |
| 反应条件 |
| 反应物 |
| 反应条件 |

