网址:http://m.1010jiajiao.com/timu_id_576652[举报]
一.选择题(本题包括8小题,每小题3分,共24分)
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
B
A
C
D
二.选择题(本题包括8小题,每小题3分,共24分)
题号
9
10
11
12
13
14
15
16
答案
B
AC
C
BC
AD
C
AD
D
三.(本题包括2小题,共20分)
17.(共8分)
(1)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (2分)
(2)①不易控制反应。②产生有毒气体,造成污染环境。(2分)
(3)c; a、b。(2分)
(4)关闭a, b,打开c (1分) 用手捂住(热水、热毛巾、加热)试管② (1分)
(合理答案均给分)
18.(每空2分,共12分)
实验一:(1)反应物本身的性质对反应速率的关系;(2分)
温度相同;(2分)
(2)Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;(2分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
实验二:(1)催化剂(或硫酸锰或Mn2+的催化作用);(2分)
 (2)B
(2分)
(2)B
(2分)
四.(本题包括2小题,共20分)
19.(每空2分,共10分)
(1)0.1;(2)1.69;
(3)①c;②(参看右图)
(4)0<c(A)<0.2mol/L;(5)B
20.(每空2分,共10分)
(1) (2分)
(2分)
(2)均为氧化还原反应 (2分)
(3)3Fe+ 4H2O  Fe 3O4+4H2↑
(2分)
Fe 3O4+4H2↑
(2分)
(4)Fe+4H++2NO3-=Fe2++2NO2↑+2 H2O (2分)
(5)取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质 (2分)
五.(本题包括1小题,共12分)
21.(共12分)
(1)1S22S22P6;(2分)(2)H2S或NH2-;(2分)
(3)A;(2分)(4)BC;(2分)(5)20; (2分)
(6)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
六.(本题包括1小题,共10分)
22.(共10分)
(1)B (2分)
(2)2H2O 2H2↑+O2↑
(2分)
2H2↑+O2↑
(2分)
(3) SO2+I2+2H2O 2HI+H2SO4 (2分)
2HI+H2SO4 (2分)
SO2和I2可循环使用,无污染。 (2分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。) (2分)
 七.(本题包括1小题,共10分)
七.(本题包括1小题,共10分)
23.(10分)
(1)134.4;
(2) (参看右图);
(3)0.068mol;
(4)
说明:本试卷中其他合理答案同样给分。
反应①:C(s)+H2O(g)
 H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1反应②:平衡常数 K2=
| [H2]?[CO2] |
| [CO]?[H2O] |
(1)K1的表达式:K1=
| C(H2)C(CO) |
| C(H2O) |
| C(H2)C(CO) |
| C(H2O) |
 H2+CO2
H2+CO2 H2+CO2
H2+CO2(2)在恒容时,对反应①,不能判断该反应达到化学平衡状态的是
A.容器中压强不变 B.混合气体中CO浓度不变
C.υ(H2)正=υ(H2O)逆 D.c(H2O)=c(CO)
(3)将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为
A.其它条件不变温度T<900℃B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应②,当升高温度时K2
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中.
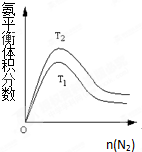
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度).则T2
(3)合成氨气所需的氢气可以由水煤气分离得到.涉及反应信息如下:
反应一:C(s)+H2O(g)?H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K2
①K1的表达式:K1=
| c(H2)?c(CO) |
| c(H2O) |
| c(H2)?c(CO) |
| c(H2O) |
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅱ) 在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为
A.其它条件不变温度T<900℃B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2

(1)图A表示溶液中_____________________________离子的变化曲线,说明曲线下降的原因:_____________________________________________________________________。
(2)对溶液进行导电性实验,当通入的混合气体体积大于V1时,引起溶液导电性明显增强的主要阳离子是___________。
(3)当n=0.02 mol时,光照前的混合气体中H2和Cl2的物质的量之比为___________。
查看习题详情和答案>>(16分)(1)配制物质的量浓度为0.2 mol/L的NaOH溶液500 mL,填空并请回答下列问题:
|
应称量NaOH的质量/g |
已给仪器 |
除已给仪器外还需要的其他仪器 |
|
|
烧杯、药匙、 托盘天平 |
|
(1)
(2)下列操作对配制的NaOH溶液浓度有偏高影响的是_______
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
(3)当向0.2 mol/L NaOH的溶液通入一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①______ _,② , ③______ __, ④ 。
(4)向0.1 mol/L的AlCl3溶液中加入过量的0.2 mol/L的NaOH溶液,则发生反应的离子方程式为 。
查看习题详情和答案>>