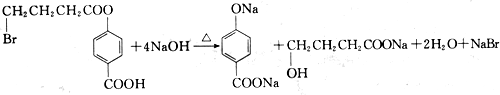
题目内容
(2008?闵行区模拟)合成氨工业对国民经济和社会发展具有重要的意义,合成氨气所需的氢气可以由水煤气分离得到.涉及反应信息如下:
反应①:C(s)+H2O(g) H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应②:平衡常数 K2=
(1)K1的表达式:K1=
;反应②的化学方程式为
(2)在恒容时,对反应①,不能判断该反应达到化学平衡状态的是
A.容器中压强不变 B.混合气体中CO浓度不变
C.υ(H2)正=υ(H2O)逆 D.c(H2O)=c(CO)
(3)将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为
A.其它条件不变温度T<900℃B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应②,当升高温度时K2
反应①:C(s)+H2O(g)
 H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1反应②:平衡常数 K2=
| [H2]?[CO2] |
| [CO]?[H2O] |
(1)K1的表达式:K1=
| C(H2)C(CO) |
| C(H2O) |
| C(H2)C(CO) |
| C(H2O) |
CO+H2O H2+CO2
H2+CO2
 H2+CO2
H2+CO2CO+H2O H2+CO2
H2+CO2
. H2+CO2
H2+CO2(2)在恒容时,对反应①,不能判断该反应达到化学平衡状态的是
D
D
(填序号).A.容器中压强不变 B.混合气体中CO浓度不变
C.υ(H2)正=υ(H2O)逆 D.c(H2O)=c(CO)
(3)将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
0.16mol/(L?min)
0.16mol/(L?min)
;(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为
D
D
(填序号)A.其它条件不变温度T<900℃B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应②,当升高温度时K2
减小
减小
(填“增大”、“减小”或“不变”).分析:(1)根据平衡常数为生成物的浓度幂之积与反应物浓度幂之积的比值来解答;
(2)根据平衡时正逆反应速率相等,各物质的浓度不变分析;
(3)(Ⅰ)利用化学反应速率的计算公式计算;
(Ⅱ)从等效平衡的角度分析;
(Ⅲ)根据实验1、2,利用等效平衡判断该反应为放热,然后根据温度对平衡的影响.
(2)根据平衡时正逆反应速率相等,各物质的浓度不变分析;
(3)(Ⅰ)利用化学反应速率的计算公式计算;
(Ⅱ)从等效平衡的角度分析;
(Ⅲ)根据实验1、2,利用等效平衡判断该反应为放热,然后根据温度对平衡的影响.
解答:解:(1)因平衡常数为生成物的浓度幂之积与反应物浓度幂之积的比值,所以K1的表达式
,反应②的化学方程式为 CO+H2O H2+CO2,故答案为:
H2+CO2,故答案为:
;CO+H2O H2+CO2;
H2+CO2;
(2)A.由于气体反应前后的化学计量数不等,所以容器中压强不变能作为判断的依据,故A正确;
B.当达到化学平衡时,混合气体中c(CO)不变,故B正确;
C.V正(H2)=V逆(H2O),说明达到平衡状态,故C正确;
D.c(CO2)与c(CO)的大小关系取决于反应起始时的物质的量的多少,不能作为判断是否达到平衡的依据,故D错误,
故答案为:D;
(3)(Ⅰ)v(CO2)=
=0.16mol/(L?min),故答案为:0.16;
(Ⅱ)实验3要达到与实验2等效的平衡状态,但到达平衡的时间短,故采取的措施要使得反应速率快,但平衡不移动,故答案为:D.
(Ⅲ)由实验1、2,利用等效平衡判断该反应为放热,升高温度,平衡向吸热的方向移动即逆向移动,所以平衡常数减小,故选:减小.
| C(H2)C(CO) |
| C(H2O) |
 H2+CO2,故答案为:
H2+CO2,故答案为:| C(H2)C(CO) |
| C(H2O) |
 H2+CO2;
H2+CO2;(2)A.由于气体反应前后的化学计量数不等,所以容器中压强不变能作为判断的依据,故A正确;
B.当达到化学平衡时,混合气体中c(CO)不变,故B正确;
C.V正(H2)=V逆(H2O),说明达到平衡状态,故C正确;
D.c(CO2)与c(CO)的大小关系取决于反应起始时的物质的量的多少,不能作为判断是否达到平衡的依据,故D错误,
故答案为:D;
(3)(Ⅰ)v(CO2)=
| 0.8mol/L |
| 5min |
(Ⅱ)实验3要达到与实验2等效的平衡状态,但到达平衡的时间短,故采取的措施要使得反应速率快,但平衡不移动,故答案为:D.
(Ⅲ)由实验1、2,利用等效平衡判断该反应为放热,升高温度,平衡向吸热的方向移动即逆向移动,所以平衡常数减小,故选:减小.
点评:本题考查化学平衡和化学反应速率等知识,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,此为化学平衡常考查问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

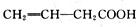
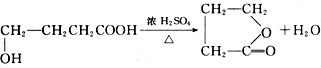
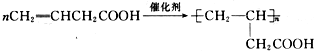 ;
;