题目内容
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O
2H2↑+O2↑
B.高温使水分解制氢:2H2O
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O
2H2↑+O2↑
D.天然气制氢:CH4+H2O
CO+3H2
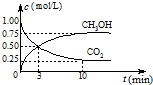
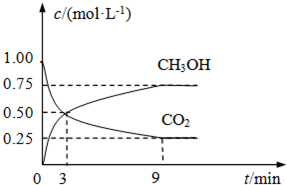
(2)CO2可转化成有机物实现碳循环.将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.反应在2分钟时达到了平衡.
①用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是
②达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图1所示,关于温度(T)和压强(P)的关系判断正确的是
A.P3>P2 T3>T2
B.P2>P4 T4>T2
C.P1>P3 T1>T3
D.P1>P4 T2>T3
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平
衡常数:
下列说法正确的是
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
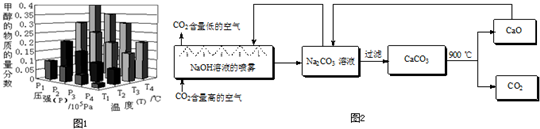
(4)二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO2(如图2).
以CO2与NH3为原料可合成化肥尿素[CO(NH2)2].已知:
2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJ?mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJ?mol-1
H2O(l)=H2O(g)△H=+88.0kJ?mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
C
C
:A.电解水制氢:2H2O
| ||
B.高温使水分解制氢:2H2O
| ||
C.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
D.天然气制氢:CH4+H2O
| ||
(2)CO2可转化成有机物实现碳循环.将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.反应在2分钟时达到了平衡.
①用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是
3υ(CO2)正=υ(H2)逆
3υ(CO2)正=υ(H2)逆
.②达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图1所示,关于温度(T)和压强(P)的关系判断正确的是
CD
CD
(填序号).
A.P3>P2 T3>T2
B.P2>P4 T4>T2
C.P1>P3 T1>T3
D.P1>P4 T2>T3
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平
衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
AC
AC
.A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
(4)二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO2(如图2).
以CO2与NH3为原料可合成化肥尿素[CO(NH2)2].已知:
2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJ?mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJ?mol-1
H2O(l)=H2O(g)△H=+88.0kJ?mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98kJ?mol-1
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98kJ?mol-1
.分析:(1)有效“减碳”的手段之一是节能,利用太阳光催化分解水制氢最节能;
(2)①可逆反应达到平衡的标志是正反应速率与逆反应速率相等;
②根据勒夏特列原理解题;
(3)A.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动;
B.根据△G=△H-T△S判断,△G>0,反应不能自发进行;△G<0,反应自发进行;
C.利用三段式计算出平衡时平衡混合物各组分的浓度,代入平衡常数的表达式计算;
D.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,不利用原料气转化.
(4)依据盖斯定律和热化学方程式计算.
(2)①可逆反应达到平衡的标志是正反应速率与逆反应速率相等;
②根据勒夏特列原理解题;
(3)A.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动;
B.根据△G=△H-T△S判断,△G>0,反应不能自发进行;△G<0,反应自发进行;
C.利用三段式计算出平衡时平衡混合物各组分的浓度,代入平衡常数的表达式计算;
D.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,不利用原料气转化.
(4)依据盖斯定律和热化学方程式计算.
解答:解:(1)有效“减碳”的手段之一是节能,利用太阳光催化分解水制氢最节能,不需要使用热量与电能,故选:C;
(2)①平衡时正逆反应速率相等,用H2与CO2浓度的变化表示该反应的速率为3υ(CO2)正=υ(H2)逆,故答案为:3υ(CO2)正=υ(H2)逆;
②P4~P1,甲醇的物质的量分数增大,平衡右移,正反应是体积减小的反应,故P4<P3<P2<P1;T1~T4,甲醇的物质的量分数增大,平衡右移,正反应是放热的反应,说明T1>T2>T3>T4,故答案为:CD;
(3)A.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A正确;
B.反应为放热反应△H<0,△G=△H-T△S<0,反应自发进行,△S<0,低温下,反应也可以自发进行,故B错误;
C.对于可逆反应:CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):0.1 0.2 0
变化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.1 0.05
所以平衡常数k=
=100,故C正确;
D.增大压强,平衡向正反应移动,有利于原料气转化.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,故升高不利用原料气转化,采取250℃温度,考虑反应速率与催化剂的活性,故D错误.
故选:AC.
(4)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJ?mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJ?mol-1
③H2O(l)=H2O(g)△H=+88.0kJ?mol-1
④2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H4
依据热化学方程式和盖斯定律①+②-③,得到△H=-159.47kJ?mol-1+116.49kJ?mol-1-88.0kJ?mol-1=-130.98KJ/mol,故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98 kJ?mol-1.
(2)①平衡时正逆反应速率相等,用H2与CO2浓度的变化表示该反应的速率为3υ(CO2)正=υ(H2)逆,故答案为:3υ(CO2)正=υ(H2)逆;
②P4~P1,甲醇的物质的量分数增大,平衡右移,正反应是体积减小的反应,故P4<P3<P2<P1;T1~T4,甲醇的物质的量分数增大,平衡右移,正反应是放热的反应,说明T1>T2>T3>T4,故答案为:CD;
(3)A.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A正确;
B.反应为放热反应△H<0,△G=△H-T△S<0,反应自发进行,△S<0,低温下,反应也可以自发进行,故B错误;
C.对于可逆反应:CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):0.1 0.2 0
变化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.1 0.05
所以平衡常数k=
| 0.05 |
| 0.05×0.12 |
D.增大压强,平衡向正反应移动,有利于原料气转化.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,故升高不利用原料气转化,采取250℃温度,考虑反应速率与催化剂的活性,故D错误.
故选:AC.
(4)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJ?mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJ?mol-1
③H2O(l)=H2O(g)△H=+88.0kJ?mol-1
④2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H4
依据热化学方程式和盖斯定律①+②-③,得到△H=-159.47kJ?mol-1+116.49kJ?mol-1-88.0kJ?mol-1=-130.98KJ/mol,故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98 kJ?mol-1.
点评:本题考查化学平衡移动、盖斯定律、化学平衡常数等,(2)为易错点,注意勒夏特列原理的应用,题目难度中等.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目