题目内容
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知下列两个反应的热效应及平衡常数:
反应①:C(s)+H2O(g)=CO(g)+H2(g)△H1=akJ?mol-1,平衡常数为K1;
反应②:C(s)+CO2(g)=2CO(g)△H2=bkJ?mo1-1,平衡常数为K2;
又知反应CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数Kc随温度的变化如下表:
回答下列问题:
(1)上述反应中,a b(填>、<或=),化学平衡常数Kc与K1、K2的关系为 .
(2)温度为800℃时,在一体积为10L的密闭容器中,通入一定量的CO和H2O (g),发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g),容器内各物质的浓度变化如下表.
800℃时物质的量浓度(mol?L-1)的变化
①表中0~2min的平均反应速率v(CO)= .
②表中第3min反应处于 状态(填“平衡”或“非平衡”);
③表中3min~4min之间,平衡向 移动(单选),可能的原因是 (单选);
表中4min~5min之间数值发生变化,可能的原因是 (单选).
a.正反应方向 b.逆反应方向 c.增加水蒸气
d.降低温度 e.使用催化剂 f.增加氢气浓度
(3)如图1、图2表示反应CO(g)+H2O(g)=CO2(g)+H2(g)在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件是 ,
②图2中时刻t2发生改变的条件是 .
反应①:C(s)+H2O(g)=CO(g)+H2(g)△H1=akJ?mol-1,平衡常数为K1;
反应②:C(s)+CO2(g)=2CO(g)△H2=bkJ?mo1-1,平衡常数为K2;
又知反应CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数Kc随温度的变化如下表:
| 温度/ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
(1)上述反应中,a
(2)温度为800℃时,在一体积为10L的密闭容器中,通入一定量的CO和H2O (g),发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g),容器内各物质的浓度变化如下表.
800℃时物质的量浓度(mol?L-1)的变化
| 时间(min) | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.120 | 0.220 | 0.080 | 0.080 |
| 3 | 0.080 | 0.180 | 0.120 | 0.120 |
| 4 | 0.100 | 0.200 | 0.100 | C1 |
| 5 | 0.067 | 0.267 | 0.133 | C2 |
②表中第3min反应处于
③表中3min~4min之间,平衡向
表中4min~5min之间数值发生变化,可能的原因是
a.正反应方向 b.逆反应方向 c.增加水蒸气
d.降低温度 e.使用催化剂 f.增加氢气浓度

(3)如图1、图2表示反应CO(g)+H2O(g)=CO2(g)+H2(g)在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件是
②图2中时刻t2发生改变的条件是
分析:(1)由表中数据可知,反应CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数Kc随温度升高而降低,故该反应为放热反应,根据盖斯定律可知,该反应由反应①-反应②得到,据此解答;
(2)①根据v=
计算v(CO);
②计算3min时的浓度商Qc,与平衡常数相比判断是否处于平衡状态;
③由表中数据可知,3min~4min之间,CO2的浓度减小0.02mol/L,CO、H2O的浓度均增大0.02mol/L,三者浓度变化量之比等于其化学计量数之比,平衡向逆反应移动,正反应为放热反应,故可能是增大氢气的浓度或升高温度;
由表中5min~6min之间数值可知,H2O的浓度增大0.067mol/L,CO浓度减小0.033、CO2的浓度增大0.033mol/L,平衡向正反应方向移动,且CO、CO2的浓度变化之比等于其化学计量数之比,应是增大水蒸气浓度;
(3)①图1中t2时刻,同等程度增大正、逆反应速率,平衡不移动,该反应是氢气体积不变的反应,故可能是增大压强或使用催化剂;
②图2中t2时刻后到达新平衡CO的浓度增大、CO2的浓度降低,平衡向逆反应方向移动,应是升高温度或增加氢气浓度或减小H2O(g)浓度.
(2)①根据v=
| △c |
| △t |
②计算3min时的浓度商Qc,与平衡常数相比判断是否处于平衡状态;
③由表中数据可知,3min~4min之间,CO2的浓度减小0.02mol/L,CO、H2O的浓度均增大0.02mol/L,三者浓度变化量之比等于其化学计量数之比,平衡向逆反应移动,正反应为放热反应,故可能是增大氢气的浓度或升高温度;
由表中5min~6min之间数值可知,H2O的浓度增大0.067mol/L,CO浓度减小0.033、CO2的浓度增大0.033mol/L,平衡向正反应方向移动,且CO、CO2的浓度变化之比等于其化学计量数之比,应是增大水蒸气浓度;
(3)①图1中t2时刻,同等程度增大正、逆反应速率,平衡不移动,该反应是氢气体积不变的反应,故可能是增大压强或使用催化剂;
②图2中t2时刻后到达新平衡CO的浓度增大、CO2的浓度降低,平衡向逆反应方向移动,应是升高温度或增加氢气浓度或减小H2O(g)浓度.
解答:解:(1)由表中数据可知,反应CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数Kc随温度升高而降低,故该反应为放热反应,根据盖斯定律可知,该反应由反应①-反应②得到,故a-b<0,即a<b,
反应①:C(s)+H2O(g)=CO(g)+H2(g),平衡常数为K1=
,
反应②:C(s)+CO2(g)=2CO(g),平衡常数为K2=
,
反应CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数Kc=
,
由平衡常数表达式可知,
=
×
,故平衡常数Kc=
,
故答案为:<;Kc=
;
(2)①由表中数据可知,0~2min内CO浓度变化量为0.2mol/L-0.12mol/L=0.08mol/L,故v(CO)=
=0.04mol/(L.min),
故答案为:0.04mol/(L.min);
②3min时的浓度商Qc=
=1,等于800℃时的平衡常数1,故处于平衡状态,
故答案为:平衡;
③由表中数据可知,3min~4min之间,CO2的浓度减小0.02mol/L,CO、H2O的浓度均增大0.02mol/L,三者浓度变化量之比等于其化学计量数之比,平衡向逆反应移动,正反应为放热反应,故可能是增大氢气的浓度或升高温度;
由表中5min~6min之间数值可知,H2O的浓度增大0.067mol/L,CO浓度减小0.033、CO2的浓度增大0.033mol/L,平衡向正反应方向移动,且CO、CO2的浓度变化之比等于其化学计量数之比,应是增大水蒸气浓度,
故答案为:b;f;c;
(3)①图1中t2时刻,同等程度增大正、逆反应速率,平衡不移动,该反应是氢气体积不变的反应,故可能是增大压强或使用催化剂,
故答案为:能是增大压强或使用催化剂;
②图2中t2时刻后到达新平衡CO的浓度增大、CO2的浓度降低,平衡向逆反应方向移动,应是升高温度或增加氢气浓度或减小H2O(g)浓度,
故答案为:升高温度或增加氢气浓度或减小H2O(g)浓度.
反应①:C(s)+H2O(g)=CO(g)+H2(g),平衡常数为K1=
| c(CO)?c(H2) |
| c(H2O) |
反应②:C(s)+CO2(g)=2CO(g),平衡常数为K2=
| c2(CO) |
| c(CO2) |
反应CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数Kc=
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
由平衡常数表达式可知,
| c(CO)?c(H2) |
| c(H2O) |
| c2(CO) |
| c(CO2) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| K1 |
| K2 |
故答案为:<;Kc=
| K1 |
| K2 |
(2)①由表中数据可知,0~2min内CO浓度变化量为0.2mol/L-0.12mol/L=0.08mol/L,故v(CO)=
| 0.08mol/L |
| 2min |
故答案为:0.04mol/(L.min);
②3min时的浓度商Qc=
| 0.12×0.12 |
| 0.08×0.18 |
故答案为:平衡;
③由表中数据可知,3min~4min之间,CO2的浓度减小0.02mol/L,CO、H2O的浓度均增大0.02mol/L,三者浓度变化量之比等于其化学计量数之比,平衡向逆反应移动,正反应为放热反应,故可能是增大氢气的浓度或升高温度;
由表中5min~6min之间数值可知,H2O的浓度增大0.067mol/L,CO浓度减小0.033、CO2的浓度增大0.033mol/L,平衡向正反应方向移动,且CO、CO2的浓度变化之比等于其化学计量数之比,应是增大水蒸气浓度,
故答案为:b;f;c;
(3)①图1中t2时刻,同等程度增大正、逆反应速率,平衡不移动,该反应是氢气体积不变的反应,故可能是增大压强或使用催化剂,
故答案为:能是增大压强或使用催化剂;
②图2中t2时刻后到达新平衡CO的浓度增大、CO2的浓度降低,平衡向逆反应方向移动,应是升高温度或增加氢气浓度或减小H2O(g)浓度,
故答案为:升高温度或增加氢气浓度或减小H2O(g)浓度.
点评:本题考查反应热计算、化学平衡常数、反应速率计算、化学平衡图象及影响因素等,以数据与图象形式考查化学平衡影响因素,侧重对学生分析思维能力考查,难度中等.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
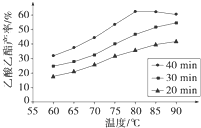 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃.在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示.(1)该研究小组的实验目的是
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是
Ⅱ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)??H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
C(s)+H2O(g)??CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2O(g)??H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是
(3)在V L密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2 842kJ(已知CO燃烧热为283kJ?mol-1,H2燃烧热为286kJ?mol-1),则T℃平衡常数K=
 H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表: 2CO(g)平衡常数K;
2CO(g)平衡常数K; CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1; H2(g)+CO2(g) 平衡常数K2,
H2(g)+CO2(g) 平衡常数K2,