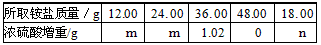网址:http://m.1010jiajiao.com/timu_id_565264[举报]
一、单项选择题(本题包括8小题,每题3分,共24分。)
1.D 2.A 3.B 4.C 5.A 6.D 7.C 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分。)
9.AB 10.A 11.CD 12.BD 13.BC 14.D
三、非选择题(本题包括6小题,共60分)
15.(10分)
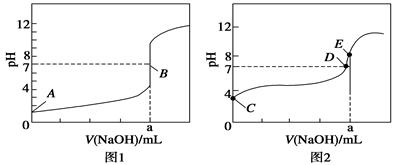
⑴ 将奶粉中氮元素全部转变为NH4+ 使反应中生成的氨气全部进入吸收液
⑵ 防止倒吸
⑶ 13.6
⑷ 无法确定氮元素是否一定来自于蛋白质
16.(8分)
|

 26%
26%

 → H2O+ 取代反应
→ H2O+ 取代反应
 n(Na2S2O3)=
n(Na2S2O3)= =35.5%
=35.5% ×100%=56%。事实上,漂白粉制备时加了水,且漂白粉还含有其他物质。
×100%=56%。事实上,漂白粉制备时加了水,且漂白粉还含有其他物质。 ② 使二氧化硫能被吸收液充分吸收
② 使二氧化硫能被吸收液充分吸收