摘要:29.已知A.B.D.E均为中学化学常见单质或化合物.它们之间的关系如图所示. (1) 若A和E为单质.组成A单质的元素是自然界中形成化合物种类最多的元素. ① B属于 分子.电子式为 ,
网址:http://m.1010jiajiao.com/timu_id_561099[举报]
 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素.
①B属于分子
非极性
非极性
(填“极性”或“非极性”),B分子中各原子最外层是
是
(填“是”或“否”)都满足8电子结构;②向50mL 4mol/L的NaOH溶液中通入1.12L B(标准状况),反应后溶液中溶质的物质的量之比为
n(Na2CO3):n(NaOH)═1:2
n(Na2CO3):n(NaOH)═1:2
(填化学式和物质的量之比);③4g A单质完全燃烧放出131.2kJ的热量,写出表示A单质燃烧热的热化学方程式
C(s)+O2(g)=CO2(g);△H=-393.6kJ/mol
C(s)+O2(g)=CO2(g);△H=-393.6kJ/mol
.(2)若A为第三周期中的元素所形成的氯化物.
①写出A溶液→B的离子方程式
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
;②写出A和B的溶液反应的离子方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(3)若A为常见的金属,在E的冷、浓溶液中,A有钝化现象.已知:X为含有非极键的离子化合物,且1mol X含有38mol电子,向D溶液中加入与D等物质的量的X固体,恰好完全反应,写出该反应的离子方程式
4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+
4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+
.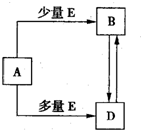 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).(1)若A、B、D的焰色反应均为黄色,且E为一种酸性的温室气体.
①写出A溶液→B溶液的离子方程式
2OH-+CO2═CO32-+H2O
2OH-+CO2═CO32-+H2O
.②下面关于化合物A、B、D的说法正确的是
AC
AC
.A.等物质的量的D与A均匀混合加热最后可得纯净物
B.用稀盐酸和澄清石灰水及相应的仪器即可检验D溶液中是否含B
C.用A溶液即可鉴别CuSO4、FeCl2、Fe2(SO4)3、Al(NO3)3、KAlO2溶液
D.往28.6g B?10H2O晶体中缓慢加入10ml 1mol?L-1H2SO4可得22.4L气体E
(2)若A为一种金属的盐酸盐RCl3,R与盐酸或氢氧化钠溶液反应均产生氢气.
①写出R与氢氧化钠溶液恰好反应得到的溶液中离子浓度的大小顺序
c(Na+)>c(AlO2-)>c(OH-)>c(H+)
c(Na+)>c(AlO2-)>c(OH-)>c(H+)
.②写出A溶液与D溶液反应的离子方程式
Al3++3AlO2-+6H2O═4Al(OH)3↓
Al3++3AlO2-+6H2O═4Al(OH)3↓
.(3)若A与D相遇会产生白烟,则①实验室制取A的化学方程式为
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.②B中的化学键类型为
| ||
离子键和极性键(或共价键)
离子键和极性键(或共价键)
.③检验A的方法及结论为用湿润的红色石蕊试纸,若变蓝则证明为氨气
用湿润的红色石蕊试纸,若变蓝则证明为氨气
.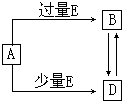 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素.
①写出B分子的结构式
②向50mL4mol/L的NaOH溶液中通入1.12L气体B(标准状况),反应后溶液中溶质的物质的量之比为
③4gA完全燃烧放出131.2kJ的热量,写出表示A的燃烧热的热化学方程式
(2)若A为第三周期某元素的氯化物,0.1mol/LE的水溶液pH=13,且其焰色反应颜色呈黄色.
①E的化学式
②写出图中A的溶液→B的溶液的离子方程式
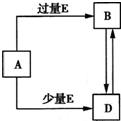 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )