网址:http://m.1010jiajiao.com/timu_id_560233[举报]
第Ⅰ卷(选择题共74分)
一.二选择题:
题号
1
2
3
4
5
6
7
8
答案
C
D
A
B
C
B
B
C
题号
9
10
11
12
13
14
15
16
17
18
答案
C
AC
BC
C
B
D
D
C
B、C
C
第Ⅱ卷(选择题共76分)
19.(1)AEF (2)AB (3)AF(或AE) (4)D
(5)安全瓶防止碱液倒吸 (2分×5)
20.(1)C(1分), B (1分)
(2)B(1分) 负极:2Cu-4e- =2Cu2+ (2分) 正极:2H2O+O2+4e- ==4OH-(2分)
21.离子方程式(略)(1)、(3);(1)中F-还原性很弱,不能使Fe3+还原为Fe2+;
(3)中F-不与SCN-反应,SCN-没有被消耗,所以当再加入足量的FeCl3溶液时,溶液又呈血红色。 (2分×3)
22.(1)弱电解质
(2)H5IO6
5 H5IO6 + 2Mn2+ = 11 H+ +2 MnO4― + 5 IO3― + 7 H2O (2分×3)
23.(1)山坡上;(2)碳酸钠溶液或碳酸氢钠溶液浸湿毛巾;
(3)肥皂水(或洗衣粉)浸湿毛巾;
(4)氢氧化钠溶液或者氢氧化钙溶液;
(5)浓氨水。(2分×5)[其它合理答案也可]
24.(1)A:H2S D:H2SO4 2H2S+3O2 == 2SO2+2H2O;
(2)A:NH3 4NH3+5O2 == 4NO + 6H2O
(3)三、ⅠA族、略
(4)S 2SO2+O2 2SO3;C(略); N2 2NO+O2==2NO2
2SO3;C(略); N2 2NO+O2==2NO2
[(1)、(2)方程式2分,其它各1分,以上条件略写出,但评分时要斟情扣分]
25.(1)NH4Cl ,①;(2)NH4Cl 和NH3?H2O(过量), NH4Cl 和HCl(过量)
(3)小于 ,大于 (1分×6)
26.解答:(1)AB (2分)(2)除去过量的铁屑(1分)(3) Fe2(SO4)3 ;废铁屑中含有氧化生成Fe2O3(或Fe3O4)被H2SO4溶解生成Fe2(SO4)3。FeSO4被空气氧化生成Fe2(SO4)3;取少许滤液,加KSCN溶液,观察溶液是否变血红色。(3分)
(4)解法一:若反应后得到的FeSO4在
x= ==34.17(mL)<50mL
==34.17(mL)<50mL
所以,蒸发后溶液尚未饱和. (3分)
解法二:若该溶液是饱和的,则其所含的 FeSO4溶质的质量为y 则
y==50×1.36× ==22.24(g)
==22.24(g)
按题意 H2SO4完全反应得到的 FeSO4的质量为:
0.5 × 200 ×10-3 ×152 =15.2
因
(5)C;(4)中求证
(
(6)(3分)解法一:
①(5)中所给
50.0ml ×
②设析出的FeSO4?7H2O的质量为X,则可列出
 =
= x=
x=
解法二:
 ×100%=17.0%
×100%=17.0%
则(50.0×1.30-x)× +
x×
+
x× =15.2
=15.2
x=11.0 (g)
①B能使湿润的红色石蕊试纸变蓝,D、F不能使湿润的石蕊试纸变色;
②A能使湿润的蓝色石蕊试纸先变红,后褪色;将红热的铜丝放入装有A的瓶中,瓶内充满棕黄色的烟;
③将点燃的镁条放入装有E的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
④D是最简单的有机物;F是空气中含量最多的气体.
⑤实验室中可用浓的C溶液与某黑色固体共热制A气体.
回答下列问题:
(1)B的化学式为
(2)③中发生反应的化学方程式是
| ||
. |
| ||
. |
(3)⑤中发生反应的化学方程式是
| ||
| ||
(4)已知标准状况下体积为1.12L的D完全燃烧生成E和液态水时,放出热量44.5kJ,写出表示1molD燃烧的热化学方程式
(5)一定条件下,向废水中加入CH3OH,将HNO3还原成F.若该反应消耗16gCH3OH转移3mol电子;该反应的化学方程式为
(1)A和D的氢化物中,稳定性较弱的是
(2)元素C在元素周期表中的位置是
(4)写出C、D的最高价氧化物的水化物之间反应的离子方程式
A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、b. c.d.е;且3 (a+b) = 2 (a+c) = 3 (d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
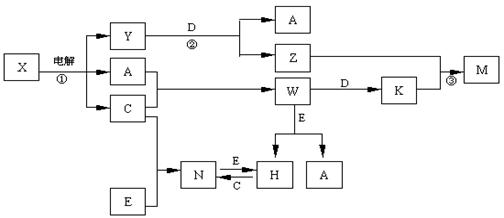
(1)Y的电子式为 ,构成D单质的元素在周期表中位于 周期 族。
(2)反应③的离子方程式为 E的氧化物与D在一定条件下反应的化学方程式为: 。
(3)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断
N为 型晶体。
(4)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为 。
查看习题详情和答案>>