题目内容
A.B.C.D.E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E与其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应,D的单质为淡黄色固体.根据以上信息,回答下列问题:
(1)A和D的氢化物中,稳定性较弱的是
(2)元素C在元素周期表中的位置是
(4)写出C、D的最高价氧化物的水化物之间反应的离子方程式
(1)A和D的氢化物中,稳定性较弱的是
D
D
选填A或D);A和B的离子中,半径较小的是Na+
Na+
填离子符号 ).(2)元素C在元素周期表中的位置是
第三周期第ⅢA族
第三周期第ⅢA族
.(3)E元素的名称是钙
钙
.(4)写出C、D的最高价氧化物的水化物之间反应的离子方程式
Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
.分析:A.B.C.D.E都是元素周期表中前20号元素,原子序数依次增大,D的单质为淡黄色固体,则D为S;A、D同主族,则A为O;B、C、D同周期,即都在第三周期,B、C、D的最高价氧化物的水化物两两混合均能发生反应,则B为Na,C为Al;E与其它元素既不在同周期也不在同主族,则为第四周期第ⅡA族,则E为Ca,然后利用元素及其单质、化合物的性质来解答.
解答:解:A.B.C.D.E都是元素周期表中前20号元素,原子序数依次增大,D的单质为淡黄色固体,则D为S;A、D同主族,则A为O;B、C、D同周期,即都在第三周期,B、C、D的最高价氧化物的水化物两两混合均能发生反应,则B为Na,C为Al;E与其它元素既不在同周期也不在同主族,则为第四周期第ⅡA族,则E为Ca,
(1)非金属性O>S,则A和D的氢化物中稳定性较弱的D,A和B的离子具有相同的电子排布,原子序数大的离子半径小,则Na+的离子半径小,故答案为:D;Na+;
(2)C为Al,在元素周期表中第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(3)E为Ca,其名称为钙,故答案为:钙;
(4)C、D的最高价氧化物的水化物分别为Al(OH)3、H2SO4,离子反应为Al(OH)3+3H+═Al3++3H2O,故答案为:Al(OH)3+3H+═Al3++3H2O.
(1)非金属性O>S,则A和D的氢化物中稳定性较弱的D,A和B的离子具有相同的电子排布,原子序数大的离子半径小,则Na+的离子半径小,故答案为:D;Na+;
(2)C为Al,在元素周期表中第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(3)E为Ca,其名称为钙,故答案为:钙;
(4)C、D的最高价氧化物的水化物分别为Al(OH)3、H2SO4,离子反应为Al(OH)3+3H+═Al3++3H2O,故答案为:Al(OH)3+3H+═Al3++3H2O.
点评:本题考查位置、结构、性质的应用,元素的推断是解答本题的关键,注意E是学生解答中的易错点,难度不大.

练习册系列答案
相关题目
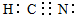
 CH3COOH+OH-
CH3COOH+OH- 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是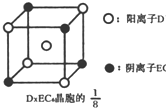
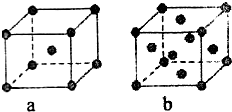 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.