摘要:(3) 离子晶体 (4) HF > SiH4 (5) 二氧化碳 一氧化二氮 二氟化铍 (6)2C+SiO2 = Si + 2CO 23答案,
网址:http://m.1010jiajiao.com/timu_id_556688[举报]
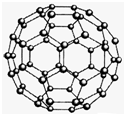 (2010?济南二模)【化学-物质结构与性质】
(2010?济南二模)【化学-物质结构与性质】C60(结构模型如图所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60?.K3C60具有超导性.
(1)碳原子的价电子排布式为
2s22p2
2s22p2
.?(2)C60分子中的杂化轨道介于石墨和金刚石的杂化轨道之间,则石墨和金刚石中碳原子的杂化方式分别是
sp2
sp2
、sp3
sp3
.(3)K3C60属于离子晶体,其中阴阳离子个数比为1:3,则该晶体的构成微粒为
K+、C603-
K+、C603-
.(用化学式表示)(4)已知C60晶体内相邻C60球体间的距离是304pm,与石墨平面层间距离(335pm)相比较,说明C60晶体中C60和C60间作用力属于
分子间作用力
分子间作用力
(填“离子键”、“共价键”或“分子间作用力”),两者数据存在差异的原因是C60的摩尔质量大于C原子的摩尔质量,故C60分子间的作用力大些、间距小些
C60的摩尔质量大于C原子的摩尔质量,故C60分子间的作用力大些、间距小些
.【化学—物质结构与性质】
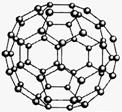 C60(结构模型如下图所示)的发现是化学界的大事之一。C60与金属钾化合生成K3C60。K3C60具有超导性。k.s.5.u
C60(结构模型如下图所示)的发现是化学界的大事之一。C60与金属钾化合生成K3C60。K3C60具有超导性。k.s.5.u
(1)碳原子的价电子排布式为 。
(2)C60分子中的杂化轨道介于石墨和金刚石的杂化轨道之间,则石墨和金刚石中碳原子的杂化方式分别是 、 。
(3)K3C60属于离子晶体,其中阴阳离子个数比为1∶3,则该晶体的构成微粒为 。(用化学式表示)
(4)已知C60晶体内相邻C60球体间的距离是304pm,与石墨平面层间距离(335pm)相比较,说明C60晶体中C60和C60间作用力属于 (填“离子键”、“共价键”或“分子间作用力”),两者数据存在差异的原因是 。
查看习题详情和答案>>某化学学习小组利用右图所示装置来探究相应物质的化学性质的顺序.选择适当试剂完成实验A、B、C,并得出相应的
实验结论.实验A、B、C所用试剂或所得结论列于下表中.
(1)乙装置的名称
(2)请填写①~⑤的试剂名称或实验结论:
①
(3)小明利用该装置自行设计了一个实验--证明NO2具有氧化性(注:丙中已事先添加Na2S溶液).据此回答下列问题:
①如何检验该装置的气密性:
②打开甲装置的活塞后,装置乙中发生反应的化学方程式为:
③某同学对小明的实验设计提出了质疑,认为丙中溶液变浑浊不足以证明NO2具有氧化性,你认为他的理由是:
④NO2气体有毒,应用NaOH溶液吸收,请写出此反应的离子方程式:
查看习题详情和答案>>

实验结论.实验A、B、C所用试剂或所得结论列于下表中.
| 序 号 |
实验药品 | 实验结论 | ||
| 甲 | 乙 | 丙 | ||
| A | ① | 二氧化锰 | ② | 氧化性:O2>S |
| B | 醋酸溶液 | 碳酸钠溶液 | 硅酸钠溶液 | ③ |
| C | ④ | ⑤ | 氯化铝溶液 | 碱性:NaOH>NH3.H2O>Al(OH)3 |
锥形瓶
锥形瓶
. (2)请填写①~⑤的试剂名称或实验结论:
①
双氧水(过氧化氢溶液)
双氧水(过氧化氢溶液)
②氢硫酸溶液
氢硫酸溶液
③酸性:醋酸>碳酸>硅酸
酸性:醋酸>碳酸>硅酸
④浓氢氧化钠溶液(或饱和氢氧化钠溶液)
浓氢氧化钠溶液(或饱和氢氧化钠溶液)
⑤氯化铵固体(晶体)
氯化铵固体(晶体)
(3)小明利用该装置自行设计了一个实验--证明NO2具有氧化性(注:丙中已事先添加Na2S溶液).据此回答下列问题:
①如何检验该装置的气密性:
关闭分液漏斗的活塞,在丙中注一定量的水,将导管插入水中,微热锥形瓶,一段时间后在导管口看到有气泡产生,撤去酒精灯,在导管中产生一段水柱,说明装置的气密性良好
关闭分液漏斗的活塞,在丙中注一定量的水,将导管插入水中,微热锥形瓶,一段时间后在导管口看到有气泡产生,撤去酒精灯,在导管中产生一段水柱,说明装置的气密性良好
;②打开甲装置的活塞后,装置乙中发生反应的化学方程式为:
Cu+4HNO3=Cu(NO3)2+2NO2?+2H2O
Cu+4HNO3=Cu(NO3)2+2NO2?+2H2O
;③某同学对小明的实验设计提出了质疑,认为丙中溶液变浑浊不足以证明NO2具有氧化性,你认为他的理由是:
3NO2+H2O=2HNO3+NO,NO2和水反应生成的HNO3是一种强氧化性的酸,也可将Na2S氧化,也可使溶液变浑浊
3NO2+H2O=2HNO3+NO,NO2和水反应生成的HNO3是一种强氧化性的酸,也可将Na2S氧化,也可使溶液变浑浊
;(用化学反应方程式和简要文字回答)④NO2气体有毒,应用NaOH溶液吸收,请写出此反应的离子方程式:
2NO2+2OH-=NO3-+NO2-+H2O
2NO2+2OH-=NO3-+NO2-+H2O
.A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D的核外电子排布图
 ,这样排布遵循了
,这样排布遵循了
查看习题详情和答案>>
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
Si
Si
BNa
Na
CP
P
DN
N
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
HNO3
HNO3
,碱性最强的是NaOH
NaOH
.(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
F
F
,电负性最大的元素是F
F
.(4)D的氢化物比C的氢化物的沸点
高
高
(填“高“或“低“),原因氨气分子之间含有氢键
氨气分子之间含有氢键
(5)E元素原子的核电荷数是
26
26
,E元素在周期表的第四
四
周期,第Ⅷ
Ⅷ
族,已知元素周期表可按电子排布分为s区、p区等,则E元素在d
d
区.(6)A、B、C最高价氧化物的晶体类型是分别是
原子
原子
晶体、离子
离子
晶体、分子
分子
晶体(7)画出D的核外电子排布图


泡利
泡利
原理和洪特
洪特
规则.A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B、A与X均可形成10个电子的化合物:B与Z的最外层电子数之比2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题:
(1)Z的原子结构示意图
 ;X原子核外电子排布式为
;X原子核外电子排布式为
(2)A与Y可形成离子晶体的化合物,该化合物的电子式为
 ,该化合物与A2X反应的化学方程式
,该化合物与A2X反应的化学方程式
(3)化合物Y2X2属于
(4)B与X可形成三原子化合物,构成该化合物晶体的粒子是
(5)A与X,A与Z均能形成18个电子的极性分子化合物,此两种化合物的化学式分别是
查看习题详情和答案>>
(1)Z的原子结构示意图


1s22s22p4
1s22s22p4
;(2)A与Y可形成离子晶体的化合物,该化合物的电子式为


NaH+H2O═NaOH+H2↑,
NaH+H2O═NaOH+H2↑,
.(3)化合物Y2X2属于
离子
离子
化合物(“离子”或“共价”).(4)B与X可形成三原子化合物,构成该化合物晶体的粒子是
分子
分子
.(5)A与X,A与Z均能形成18个电子的极性分子化合物,此两种化合物的化学式分别是
H2O2
H2O2
和H2S
H2S
.