网址:http://m.1010jiajiao.com/timu_id_549743[举报]
(8分)在T℃时,水的离子积为KW=10—12,在此温度下,将pH=a的盐酸溶液Va L与pH=b的Ba(OH)2溶液Vb L混合:
(1)由数据可以判断T 25(填 “大于” 、“小于”、 “等于”);理由是: 。
(2)若所得混合液为中性,且a+b=10,则Va︰Vb为 ;
(3)若所得混合液的pH=10,且a=2,b=12则Va︰Vb为 。
查看习题详情和答案>>(1)由数据可以判断T 25(填“大于” 、“小于”、“等于”);理由是: 。
(2)若所得混合液为中性,且a+b=10,则Va︰Vb为 ;
(3)若所得混合液的pH=10,且a=2,b=12则Va︰Vb为 。
在T℃时,水的离子积为KW=10-12,在此温度下,将pH=a的盐酸溶液Va L与pH=b的Ba(OH)2溶液Vb L混合:
(1)由数据可以判断T________25(填“大于”、“小于”、“等于”);理由是:________.
(2)若所得混合液为中性,且a+b=10,则Va∶Vb为___________;
(3)若所得混合液的pH=10,且a=2,b=12则Va∶Vb为________.
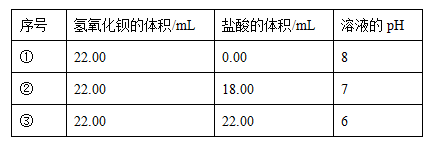
(2)b=________,原Ba(OH)2稀溶液的物质的量浓度为________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为________,其中Na2SO4的物质的量浓度为________。
(1)25℃时,某NaCl溶液中c(Cl–)=1×10-4 mol·L–1,则该溶液中c(Na+)∶c(OH-)=
(2)25℃时,将0.1 mol·L–1NaOH溶液与0.06 mol·L–1的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= 。25℃时,pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近 。
(3)25℃时,下列四种溶液中,①pH=0的盐酸 ②0.1 mol·L–1的盐酸 ③0.01 mol·L–1的NaOH溶液 ④pH=11的NaOH溶液,由水电离生成氢离子浓度之比①︰②︰③︰④是: (填字母)
| A.1︰10︰100︰1000 | B.0︰1︰12︰11 |
| C.14︰13︰12︰11 | D.14︰13︰2︰3 |
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH-)=________。
③该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,pH=______________
(5) 纯水中c(H+)=5.0×10–7 mol·L–1,则此时纯水中的c(OH–) = ;若温度不变,滴入稀硫酸使c(H+)=5.0×10–3 mol·L–1,则c(OH–) = ;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH–)=5.0×10–2 mol·L–1,则溶液中c(H+)= 。 查看习题详情和答案>>