网址:http://m.1010jiajiao.com/timu_id_549611[举报]
一、(本题包括18小题,共54分)
1.D2.C3.D4.C5.A6.D7.B8.B9. B 10. B 11. C 12. B 13.D14.A15.A16.A17.C18.B
二、(本题包括4小题,共16分)
1.(2分)(1)N2H4(l)+2H2O2(l)= N2 (g) +4H2O (g);△H=-640 kJ?mol-1
2.(4分)(1)TiCl4+2Mg=Ti+2MgCl2(2)―80 kJ?mol-1
3.(4分)(1) 3X+Y.files\image024.gif) 2Z (2) 0.05
2Z (2) 0.05
4.(6分)①大于或等于 ② > ③ A C
三、(本题包括2小题,共14分)
1. (5分)(1)0.05mol?L-1 (2)③ ⑸
2..(9分)(1)0.25(2)[H2] = 0.016mol?L-1,[HI]= 0.0080mol?L-1
四、(本题包括2小题,共16分)
1.(8分)(1)不能(2分);因为酚酞的变色范围为8~10,即pH范围呈碱性,而BaCO3需在酸性溶液中才会不断溶解。(2分)
(2)偏高(2分);因为甲基橙的变色范围的pH为3.1~4.4,当滴定到甲基橙由黄色变到橙色时,溶液的pH已经降到4.4以下,此时已有部分BaCO3与盐酸反应,故消耗的盐酸的量偏大。(2分)
2.(8分)(1)偏低 (2分)
(2)25%(3分)
(3)37.5%(3分)
利用光能和光催化剂,可将CO2和H2O转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下左图所示。


(1)在0-30小时内,CH4的平均生成速率vI、vII和vIII从大到小的顺序为 ;反应开始后的12小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,一定温度下发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) K=27mol2·L-2。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,在上述温度下发生反应达到平衡,测得CO的物质的量为0.10mol,CH4的平衡转化率为 (保留两位有效数字)。
CO(g)+3H2(g) K=27mol2·L-2。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,在上述温度下发生反应达到平衡,测得CO的物质的量为0.10mol,CH4的平衡转化率为 (保留两位有效数字)。
(3)甲烷燃料电池是利用CH4跟氧气或空气反应将化学能转化成电能的装置,电解质溶液是强碱。下面有关说法正确的是 (填编号)。
A.负极反应为:O2+2H2O+4e- -→4OH-;
B.负极反应为:CH4+10OH- - 8e--→CO32-+7H2O
C.放电时溶液中的阴离子向负极移动
D.随放电的进行,溶液的pH值不变
(4)如上右图是一个电化学装置示意图,甲烷燃料电池作其电源。
①如果A为含有铁、银、金、碳杂质的粗铜,B为纯铜,C为CuSO4溶液,通电后,Cu2+的浓度将 (填“增大”、“减小”或“不变”)。
②如果A是铂电极,B是石墨电极,C是KBr溶液,通电时阳极的电极反应式是__________________________。
③特定条件下,该装置使用惰性电极电解Na2SO4浓溶液可制得少量过氧化氢:在阳极上SO![]() 被氧化成S2O
被氧化成S2O![]() (过二硫酸根离子),S2O
(过二硫酸根离子),S2O![]() 与H2O反应即可生成H2O2,
与H2O反应即可生成H2O2,
S2O![]() +2H2O === 2SO
+2H2O === 2SO![]() +H2O2+2H+。若各反应物质的转化率均为100%,则要制取1 mol H2O2,理论上燃料电池需消耗CH4的物质的量为 。
+H2O2+2H+。若各反应物质的转化率均为100%,则要制取1 mol H2O2,理论上燃料电池需消耗CH4的物质的量为 。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g)?4C(g)△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)=4mol/L.试确定B的起始浓度c(B)的取值范围是
①增加C的物质的量②加压 ③升温④使用催化剂
(2)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
已知C(s)+H20(g)?CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)?C0(g)+H20(g)的平衡常数为K2,则K与K1、K2二者的关系为
(3)已知某温度下,反应2SO2+02?2S03的平衡常数K=19.在该温度下的体积固定的密闭容器中,c0(SO2)=1mol?L-1c0(O2)=1mol?L-1,当反应在该温度下SO2转化率为80%时,该反应
(4)对于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H=xkJ?mol-1;若a+b>c+d,增大压强平衡向
 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)
A、增加C的物质的量 B、加压 C、升温 D、使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.分析该溶液遇酚酞呈红色原因(用离子方程式表示)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
(4)在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1mol?L-1的盐酸时,溶液中c(Ag+)
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)![]() 4C(g) ΔH>0达到平衡时,c(A)=2 mol/L,c(B)=7 mol/L,c(C)=4 mol/L.试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________
4C(g) ΔH>0达到平衡时,c(A)=2 mol/L,c(B)=7 mol/L,c(C)=4 mol/L.试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________
①增加C的物质的量
②加压
③升温
④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是________
(填“A”或“B”).设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2.则m1________m2(选填“<”、“=”、“>”)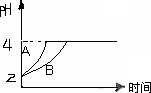
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点–54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g)1.试写出常温常压下化学平衡常数K的表达式:K=________;
若在此条件下,将化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是________(选填编号).
a.降低温度
b.移走SO2Cl2
c.增加反应物浓度
d.无法满足上述条件
2.为了提高上述反应中Cl2的平衡转化率,下列措施合理的是________(选填编号).
a.缩小容器体积
b.使用催化剂
c.增加SO2浓度
d.升高温度
在100℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有________(选填编号).
a.只有37Cl2
b.只有SO237Cl2
c.37Cl2和SO237Cl2
d.无法判断
3.下列描述中能说明上述反应已达平衡的是________(选填编号).
a.v(Cl2)=v(SO2)
b.容器中气体压强不随时间而变化
c.c(Cl2)∶c(SO2)=1∶1
d.容器中气体颜色不随时间两变化
4.300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO27.616 g.若在上述中的平衡体系中,再加入16.20 g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________.