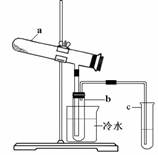
摘要:(1)生产硫酸最古老的方法是以绿矾为原料.在蒸馏釜中煅烧.反应的化学方程式为:2FeSO4?7H2OFe2O3+SO2+SO2↑+14H2O.其中三氧化硫与水蒸气同时冷凝便得到硫酸.用如图所示装置模拟用绿矾制硫酸的实验.并检验生成的硫酸和二氧化硫.其中b为干燥的试管.① 试管b中得到的主要产物是 .检验该产物的方法是(结合离子方程式简要说明) .② 为检验反应的另一种生成物.试管c中应加入的试剂是 .简述相应的实验现象及结论 .③ 所得硫酸的理论浓度为 .(2)目前.我国采用“接触法 制硫酸.生产设备如图所示:
网址:http://m.1010jiajiao.com/timu_id_54356[举报]
 生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:2FeSO4?7H2O
| ||
查看习题详情和答案>>
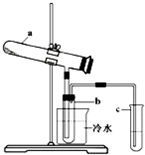
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O  Fe2O3 + SO2↑+
SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
Fe2O3 + SO2↑+
SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42—
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
查看习题详情和答案>>
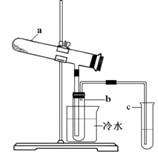
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
2FeSO4-7H2O
Fe2O3+SO2↑+SO3↑+14H2O.其中三氧化硫与水蒸气同时冷凝便得到硫酸.用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去).其中b为干燥的试管.下列关于该反应说法正确的是( )

查看习题详情和答案>>
2FeSO4-7H2O
| ||
| A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4 |
| B.b中产物用紫色石蕊试液即可检验出其中H+和SO42- |
| C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |

 Fe2O3+SO2↑+SO3↑+14H2O.其中三氧化硫与水蒸气同时冷凝便得到硫酸.用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去).其中b为干燥的试管.下列关于该反应说法正确的是( )
Fe2O3+SO2↑+SO3↑+14H2O.其中三氧化硫与水蒸气同时冷凝便得到硫酸.用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去).其中b为干燥的试管.下列关于该反应说法正确的是( )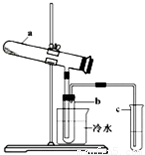
 Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是