网址:http://m.1010jiajiao.com/timu_id_540272[举报]
(1)混合后5—10 s内,溶液由橙色变为暗蓝色;
(2)在80—160 s内由暗蓝色为绿色,与此同时放出气泡。与之相应的两个反应式为:
A:![]() +H2O2+H+——CrO5+H2O
+H2O2+H+——CrO5+H2O
(橙色) (暗蓝色)
B:CrO5+H+——Cr3++O2↑
(绿色)
两步反应的速率方程分别为
vA=k1c(![]() )·c(H2O2),vb=k2c(CrO5)
)·c(H2O2),vb=k2c(CrO5)
请回答下列问题:
(1)配平A、B反应方程式及由A、B反应组成的总反应方程式。
(2)当要用K2Cr2O7溶液滴定H2O2时,请计算1 mL浓度为0.02 mol·L-1的K2Cr2O7溶液与多少摩尔的H2O2恰好完全反应。
(3)已知铬的最高价为+6,试推测蓝色中间物CrO5的结构式为__________。
(4)判断A、B两个反应哪个速率快。
查看习题详情和答案>>已知反应①、②是化工生产中的两个重要反应
①甲溶液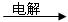 A + B + C
A + B + C
②乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是 。
(2)将A通入B的溶液中,反应的离子方程式是 。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是 。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是 。
(5)化工生产②中第二步、第三步用到的设备名称分别为 、 。第二步采用的反应条件为 。
(6)将A和D按物质的量1:1通入下列装置中:
该过程中的化学方程式是: _______________________。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(7)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是 。
卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 ????????? 区;氟原子的电子排布图为?????? 溴原子的价电子排布式为????? .
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是??????????
(3)已知高碘酸有两种形式,化学式分别为H5IO6 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??????????? HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为???????????? 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??????????? HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为???????????? 。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 ??? 式发生。
A.CsICl2=CsCl+ICl?????? B.CsICl2 =CsI +Cl2
(5)ClO2-的空间构型为?????? 型,中心氯原子的杂化轨道类型为???????? ,写出一个ClO2-的等电子体 ???????????? 。
(6)如图为碘晶体晶胞结构。有关说法中正确的是???? 。

A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3 .NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为?????? 。
查看习题详情和答案>>
已知反应 ①、② 是化工生产中的两个重要反应
① 甲溶液![]() A + B + C
A + B + C
② 乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是 。
(2)将A通入B的溶液中,反应的离子方程式是 。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是 。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是 。
(5)化工生产②中第二步、第三步用到的设备名称分别为 、 。第二步采用的反应条件为 。
(6)将A和D按物质的量1:1通入下列装置中:

该过程中的化学方程式是: _______________________。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(7)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是 。
查看习题详情和答案>>