题目内容
K2Cr2O7和H2O2在H2SO4溶液中混合,可以看到下面两个现象:(1)混合后5—10 s内,溶液由橙色变为暗蓝色;
(2)在80—160 s内由暗蓝色为绿色,与此同时放出气泡。与之相应的两个反应式为:
A:![]() +H2O2+H+——CrO5+H2O
+H2O2+H+——CrO5+H2O
(橙色) (暗蓝色)
B:CrO5+H+——Cr3++O2↑
(绿色)
两步反应的速率方程分别为
vA=k1c(![]() )·c(H2O2),vb=k2c(CrO5)
)·c(H2O2),vb=k2c(CrO5)
请回答下列问题:
(1)配平A、B反应方程式及由A、B反应组成的总反应方程式。
(2)当要用K2Cr2O7溶液滴定H2O2时,请计算1 mL浓度为0.02 mol·L-1的K2Cr2O7溶液与多少摩尔的H2O2恰好完全反应。
(3)已知铬的最高价为+6,试推测蓝色中间物CrO5的结构式为__________。
(4)判断A、B两个反应哪个速率快。
(1)A:![]() +4H2O2+2H+====2CrO5+5H2O
+4H2O2+2H+====2CrO5+5H2O
B:4CrO5+12H+====4Cr3++7O2↑+6H2O
总反应:2![]() +8H2O2+16H+====4Cr3++7O2↑+16H2O
+8H2O2+16H+====4Cr3++7O2↑+16H2O
(2)8×10-5 mol (3) 
(4)A反应快
解析:配平A、B两式,然后两式叠加得总反应式:2![]() +8H2O2+16H+====4Cr3++7O2↑+16H2O;根据A式或总反应式得
+8H2O2+16H+====4Cr3++7O2↑+16H2O;根据A式或总反应式得
![]() — 4H2O2,
— 4H2O2,
1×10-3×0.02 mol 4×1×10-3×0.02 mol
即1 mL浓度为0.02 mol·L-1的K2Cr2O7溶液可与8×10-5 mol H2O2恰好完全反应;依据价键饱和原则,根据熟知的O==C==O和H—O—O—H结构类推,可得CrO5的结构式;根据题给信息(1)(2)可知A反应快。

(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
请完成并配平上述化学方程式.其中氧化剂是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
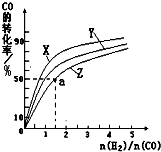
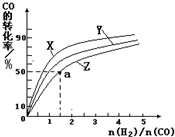
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
 2NH3。
2NH3。