网址:http://m.1010jiajiao.com/timu_id_516456[举报]
生物部分
选择题答案:1.B 2.A 3.C 4.C 5.D 6.C
30.(每空2分,共28分)
1.(1)氧气、二氧化碳 (2)叶绿体和线粒体(3)①③ (4)催化两种反应的酶不同
(5)1mol 葡萄糖分解为2mol物质A时释放了能量
Ⅱ(1)下丘脑(神经分泌)细胞 甲状腺激素 一 (2)①效应器 X、Y
化学信号②0 2
③将药物放在X点,刺激Y点,观察效应器的反应(或药物放在Y点,刺激Y点,观察电流表发生偏转情况)
31.(每空2分,共16分)
I.(1)①因为小鼠无毛性状可遗传给后代,并且在种群中常见形状为有毛。
②无毛小鼠与亲代有毛小鼠杂交后代中有毛和无毛形状没有出现性别差异。
(2)方案:让无毛小鼠与亲代有毛小鼠杂交后代中的有毛小鼠♀×无毛小鼠♂杂交
选择的理由:亲本均具正常生育能力, 后代无毛小鼠出现概率较高,为1/2 ,具有毛雌小鼠繁殖能力高,哺乳正常
(若方案为:杂合有毛小鼠♀×杂合有毛小鼠♂,后代无毛小鼠出现概率较低,为1/4:若方案为:无毛小鼠♀×杂合有毛小鼠♂或无毛小鼠♀×无毛小鼠♂,则纯合隐性毛雌鼠繁殖能力低,哺乳困难。所以不给分)
11.(1)3 2
(2)
(3)
化学部分
选择题答案:7~13:BDDCCBA
26.(12分) (1) (3分);
(3分);
 (2)
(2)
(3)
(4)
27.(12分 每空2分)
(1)①负极  (或
(或 )
)
②正极  (或
(或 )
)
(2)变蓝
28.(17分) (1)

(2)

(3)
(4) 羟基 羧基
(5)
(6) (邻、间、对均可)
(邻、间、对均可)
29(17分)(1)固体完全溶解,溶液呈血红色
(2)


 (每个离子方程式2分,共6分)
(每个离子方程式2分,共6分)
(3)取 固体粉末在空气中充分加热,待质量不再变化时,称其质量为
固体粉末在空气中充分加热,待质量不再变化时,称其质量为 ,则混合物中
,则混合物中 的质量分数为
的质量分数为
(4)①B、D ② ③加热浓缩,降温结晶
③加热浓缩,降温结晶
物理部分
选择题答案:14.A 15.C 16.A 17.B 18.BC 19.AC 20.C 21.BD
22.(17分)
 ABD(5分,部分选对得3分,有错选得0分)
ABD(5分,部分选对得3分,有错选得0分)
Ⅱ(1) (2)平衡摩擦力(表术类同均可得分) ,
(2分)
小车与砝码的总质量远大于钩码总质量或 。
。
(2)(2分)
测量点



C
5.08(1分)
0.48(1分)
0.24
(
(3)可获得的结论是外力所做的功与物理速度平方的变化成正比(2分)。
 绘图4分, 直线正确给2分,横纵坐标互换
绘图4分, 直线正确给2分,横纵坐标互换
或横坐标为S也给2分
23.(17分)
解:秋千摆的过程,由机械能守恒
可得 
解得 
在星球表面 

联立解得 

 即
即
24.(18分)
解:(1)物体开始运动,
离开墙壁时 即
即
 解得:
解得:
(2) 至
至 时间内物体处于精制状态
时间内物体处于精制状态
 至
至  时间内物体处于 变加速直线运动
时间内物体处于 变加速直线运动
 至落地时间内物体处于变加速曲线运动或
至落地时间内物体处于变加速曲线运动或
离开墙壁过程在竖直方向
解得 

25.(20分)
解:(1)线框在磁场中匀速运动,则
由公式得 


由以上四式联立解得:
由动能定理得  解得
解得
(2)由能量守恒可知:
(从电流热效应求得正确结果也给分)
(3)撤去档板后,线框在磁场中水平方向所受合力为0,竖直方向只受重力,因此,线框在穿越磁场过程作类平抛运动。
水平方向:
竖直方向:

撤去挡板前后,线框产生热量相同,即
A、B、C、D、E、F六种物质在一定条件下有如右图所示的相互转化关系,所有反应物和生成物均已给出.
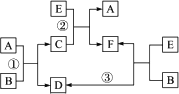
(1)若反应①②③均为溶液中的置换反应,A、D、E为常见金属单质,则A、D、E的还原性由强到弱的顺序为________.请写出满足以上要求的离子方程式:
反应①________.反应②________.
(2)若反应①②③均为复分解反应.请写出满足要求的化学方程式:
反应①________.
反应②________.
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是________.
Ⅰ.实验测得,1 g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。
A. 2H2(g)+O2(g)=2H2O(l) △H=-142.9kJ/mol
B. H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
C. 2H2+O2=2H2O(l) △H=-571.6 kJ/mol
D. H2(g)+1/2O2(g)=H2O(g) △H=-285.8 kJ/mol
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O
 CaO+2HBr
CaO+2HBr②2HBr+Hg
 HgBr2+H2
HgBr2+H2 ③HgBr2+_____
 ______
______ ④2HgO2
 Hg+O2↑
Hg+O2↑ 请你根据“原子经济”的思想完成上述步骤③的化学方程式:__________________。根据“绿色化学”的思想评估该方法制H2的主要缺点:_______。
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O) 完成下列反应的化学方程式:
反应①_______________;反应②_____________。此法制取氢气的最大优点是__________________

 CO2(g)+H2(g) △H<0 在850℃时,
CO2(g)+H2(g) △H<0 在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K_____(填“大于”“小于”或“等 于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、 1.0 molCO2和xmol H2,则 ①当x=5.0时,上述平衡向_____(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0 mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a_____(填“大于”“小 于”或“等于”)b。
V.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O 在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8g氧化铜被氢气还原后,得到红色固体6.8 g,其中含单质铜与氧化亚铜的物质的量之比是_____;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体_______g;
(3)若将6 8 g上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1. 568 L的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分
是_______,其物质的量之比是_______;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤出来,得晶体23. 68 g。经分析,原溶液中的Cu2+有
20%残留在母液中。求所得晶体的化学式:_______。
“氢能”将是未来最理想的新能源.
Ⅰ.实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为________.(填序号)
A.
2H2(g)+O2(g)B.H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2+O2![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+1/2O2(g)![]() H2O(g) ΔH=-285.8 kJ·mol-1
H2O(g) ΔH=-285.8 kJ·mol-1
Ⅱ
.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤①CaBr2+H2O CaO+2HBr
CaO+2HBr
②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+________ ________
________
④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________.
根据“
绿色化学”的思想评估该方法制H2的主要缺点:________.Ⅲ
.利用核能把水分解制氢气,是目前正在研究的课题.下图是其中的一种流程,其中用了过量的碘.(提示:反应②的产物是O2、SO2和H2O)
完成下列
反应的化学方程式:反应①________;反应②________.
此法制取
氢气的最大优点是________.Ⅳ
.氢气通常用生产水煤气的方法制得.其中CO(g)+H2O(g)(1)若升高温度到950℃时,达到平衡时K________1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填正反应或逆反应)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________.
(3)在850℃时,若设x=5.0 mol和x=6.0 mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a________b(填“大于”、“小于”或“等于”).
Ⅴ
.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜.(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是________;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体________g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是________,其物质的量之比是________;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68 g.经分析,原溶液中的Cu2+有20%残留在母液中.求所得晶体的化学式