题目内容
工业制硫酸时,利用催化氧化反应将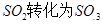 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下, 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol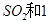 mol
mol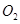 ,发生反应:
,发生反应: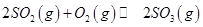 ,达平衡后改变下述条件,
,达平衡后改变下述条件,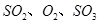 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol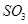
B.保持温度和容器体积不变,充入2molN2
C.保持温度和容器内压强不变,充入1mol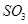
D.移动活塞压缩气体
E.升高温度
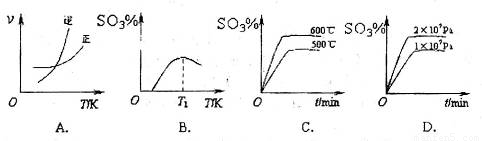
(3)下列关于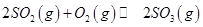 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。
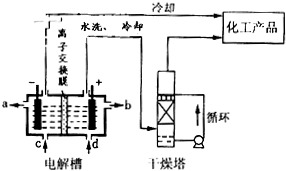
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境。于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸。
①阳极的电极反应为______________________________。
②若电解液为2L0.025mol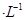 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价____________________________(写出一点即可)。
(每空2分)
(1)10/3或3.33
(2)A、D
(3)C
(4)2SO2 – 4e‾ + 4H2O = 2SO42‾ +8H+ 1.12L 1
耗费大量的电能,不经济;产率低,不能大规模生产
【解析】
试题分析: (1)转化的SO2为:196kJ÷98kJ•mol‾1=2mol,根据三行式计算:
SO2 + 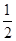 O2
O2
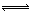 SO3
SO3
初始浓度(mol•L‾1) 0.04 0.1 0
转化浓度(mol•L‾1) 0.02 0.01 0.02
平衡浓度(mol•L‾1) 0.02 0.09 0.02
可得平衡常数K=0.02÷(0.02×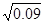 =10/3
=10/3
(2)A、增加SO3,平衡逆向移动,三者浓度都增大;B、N2与反应无关,三者浓度都不变;C、保持压强不变,充入SO3,根据等效平衡原理,三者浓度不变;D、加压后各物质的浓度都大于原平衡;E、升高温度,平衡逆向移动,SO2、O2浓度增大,SO3浓度减小。
(3)A、温度升高,平衡逆向移动,逆反应速率增加的倍数大,正确;B、图像的前半段为反应建立平衡的过程,SO3%逐渐增大,T1之后的阶段为化学反应随温度的升高平衡移动的过程,升高温度,平衡逆向移动SO3%逐渐减小,图像正确;C、600℃高于500℃,平衡逆向移动,SO3%逐渐减小,图像错误;D、增大压强,平衡正向移动,SO3%增大,图像正确。
(4)①阳极上发生失电子反应,SO2失电子生成SO42‾。
②V(SO2) =0.1mol÷2×22.4L/mol=1.12L;
pH=-lg(0.1mol×2÷2L)=1
③电解需要消耗大量的电能,所以本设计耗费大量的电能,不经济;产率低,不能大规模生产。
考点:本题考查平衡常数的计算、化学平衡的移动、化学平衡的图像、电解池电极方程式的书写及计算。