网址:http://m.1010jiajiao.com/timu_id_499902[举报]
1.B 2.C 3.C 4.B 5.B 6.C 7.C 8.B 9.C 10.AC 11.AD 12.D
13.B 14.A 15.B 16.D 17.B 18.B 19.D 20.D 21.C 22.C
23.(1) ;
; ;(2)HCl;
;(2)HCl; ;(3)HCl、
;(3)HCl、 、
、
24.(1) 、
、 、
、 ;(2)铁粉,Ag (3)
;(2)铁粉,Ag (3) 、
、 、
、 、
、 ;
;
25.D的式量比C大16,猜想Y是 .
. 的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的化合物,说明A是弱酸的铵盐
(1)

 (2)
(2) (3)
(3)
(4) 或
或
26.(1)Fe、C、Si、Al (2)Fe、C  、
、
 、
、
 、
、
(3)
(4)

27.(1)Mg  C
C  MgO CO (2)
MgO CO (2) Fe
Fe 



(3) ,
,

 ,
,
29.(1) (2)设金属元素的原子量为x
(2)设金属元素的原子量为x

x+16 44
 x=40,该金属元素是Ca,氧化物E的化学式是CaO
x=40,该金属元素是Ca,氧化物E的化学式是CaO
(3) ,设G的分子量为y,则
,设G的分子量为y,则 ,y=44,若G
,y=44,若G
分子中含有1个O原子,则44-16=28,28是N原子量的2倍,则G是 ,若G分子中含2个O原子,则44-32=12,则G是
,若G分子中含2个O原子,则44-32=12,则G是 ,不合题意
,不合题意
(4) ,
,
30.(1)由于向溶液中滴加盐酸,无现象,再滴加 溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
(2)



b+34 18 18
解得 b=24,∴ B是镁元素

x∶y∶z=0.01∶0.01∶0.06=l∶1∶6
∴ x=1;y=1;z=6
(3)A的原子量为 ,∴ A是钾元素
,∴ A是钾元素
A元素的名称是钾
(4)复盐的化学式为
(5)焰色反应 www.ks5u.com
www.ks5u.com
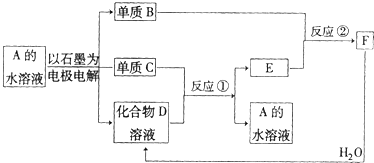
(1)若反应①和②不需要特定的反应条件就能进行,且A为无色溶液.则C.E.F的化学式分别是
| ||
| ||
(2)若反应①和②需要在一定条件才能进行,则电解A溶液的两极反应式分别为
| ||
| ||
当有1mol电子转移时,标况下生成
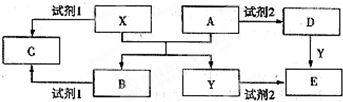
(1)若试剂1与试剂2不属于同类物质,则X与试剂1反应的离子方程式是
(2)若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A的化学式是
①检验物质D的溶液中金属离子的实验操作是
②将物质C溶于水,其溶液呈
(3)若E溶液隔绝空气加热、蒸干后,可得到该溶液的溶质,工业上用E、稀硫酸和NaNO2为原料来制备高效净水剂Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
①A和E的溶液显碱性,0.1mol?L-1 A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀.
(1)根据以上事实推断A、B、E的化学式:A
(2)写出③和④的离子方程式:
③
④
 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.(1)写出各下列物质的化学式:则A是
(2)写出下列反应的化学方程式:B→C
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:(1)若常温下A为有色气体
①若F是一种金属单质,请写出B和适量F反应生成C与气体E的离子方程式:
②若C为直线型分子,E具有漂白性,物质F焰色反应呈黄色,则C的结构式为:
(2)若A为淡黄色固体,且物质A和D的式量相等,请用离子方程式表示物质F的水溶液呈酸性的原因:
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的
| 1 | 5 |
