题目内容
有A.B.C.D.E.F六种物质,转化关系如下: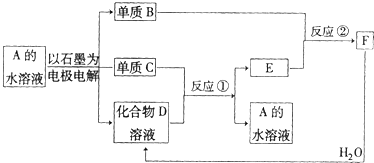
(1)若反应①和②不需要特定的反应条件就能进行,且A为无色溶液.则C.E.F的化学式分别是
(2)若反应①和②需要在一定条件才能进行,则电解A溶液的两极反应式分别为
当有1mol电子转移时,标况下生成

(1)若反应①和②不需要特定的反应条件就能进行,且A为无色溶液.则C.E.F的化学式分别是
Ag、NO、NO2
Ag、NO、NO2
;电解A溶液的离子方程式为4Ag+2H2O
4Ag+O2↑+4H+
| ||
4Ag+2H2O
4Ag+O2↑+4H+
; 若电解A溶液500mL,一段时间后溶液的pH由4变为1,则阴极析出固体的质量为
| ||
5.4
5.4
g.(2)若反应①和②需要在一定条件才能进行,则电解A溶液的两极反应式分别为
2Cu2++4e-=2Cu
2Cu2++4e-=2Cu
;4OH--4e?=2H2O+O2↑
4OH--4e?=2H2O+O2↑
; C和D的稀溶液不反应,但若通入B气体,在加热条件下可以反应生成A溶液.试写出这一反应的化学方程式2Cu+O2+2H2SO4
2CuSO4+2H2O
| ||
2Cu+O2+2H2SO4
2CuSO4+2H2O
.
| ||
当有1mol电子转移时,标况下生成
5.6
5.6
L单质B.分析:A溶液电解生成三种物质,A为盐溶液,生成两种单质,水一定发生电解,A可能为氯化物,其阳离子金属活性排在Cu之前,可能为含氧酸盐,阳离子金属活性排在Cu及Cu后,
(1)若反应①和②不需要特定的反应条件就能进行,且A为无色溶液,A应为硝酸银,结合转化关系可知,B为氧气,C为Ag,D为硝酸,E为NO,F为二氧化氮,符合题意,据此解答;
(2)若反应①和②需要在一定条件才能进行,A应为硫酸铜,结合转化关系可知,B为氧气,C为Cu,D为硫酸,E为二氧化硫,F为三氧化硫,符合题意,据此解答.
(1)若反应①和②不需要特定的反应条件就能进行,且A为无色溶液,A应为硝酸银,结合转化关系可知,B为氧气,C为Ag,D为硝酸,E为NO,F为二氧化氮,符合题意,据此解答;
(2)若反应①和②需要在一定条件才能进行,A应为硫酸铜,结合转化关系可知,B为氧气,C为Cu,D为硫酸,E为二氧化硫,F为三氧化硫,符合题意,据此解答.
解答:解:A溶液电解生成三种物质,A为盐溶液,生成两种单质,水一定发生电解,A可能为氯化物,其阳离子金属活性排在Cu之前,可能为含氧酸盐,阳离子金属活性排在Cu及Cu后,
(1)若反应①和②不需要特定的反应条件就能进行,且A为无色溶液,A应为硝酸银,结合转化关系可知,B为氧气,C为Ag,D为硝酸,E为NO,F为二氧化氮,
通过以上分析知,C、E、F分别是Ag、NO、NO2;
电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电生成银,所以其电解离子方程式为:4Ag+2H2O
4Ag+O2↑+4H+;
电解时,溶液的pH由4变为1,则溶液中氢离子的物质的量=0.1mol/L×0.5L=0.05mol,
根据氢离子和氧气之间的关系式得氧气的体积=
×4×108g/mol=5.4g,
故答案为:Ag、NO、NO2;4Ag+2H2O
4Ag+O2↑+4H+;5.4;
(2)若反应①和②需要在一定条件才能进行,A应为硫酸铜,结合转化关系可知,B为氧气,C为Cu,D为硫酸,E为二氧化硫,F为三氧化硫,
电解硫酸铜溶液时,阴极上铜离子放电生成铜,阳极上氢氧根离子放电生成氧气,所以阴极、阳极电极反应式分别为:2Cu2++4e-=2Cu、4OH--4e?=2H2O+O2↑;
铜、氧气和稀硫酸在加热条件下反应生成硫酸铜和水,反应方程式为2Cu+O2+2H2SO4
2CuSO4+2H2O,
根据转移电子和生成氧气之间的关系式知,生成氧气的体积=
×22.4L/mol=5.6L,
故答案为:阴极:2Cu2++4e-=2Cu;阳极:4OH--4e?=2H2O+O2↑;2Cu+O2+2H2SO4
2CuSO4+2H2O;5.6.
(1)若反应①和②不需要特定的反应条件就能进行,且A为无色溶液,A应为硝酸银,结合转化关系可知,B为氧气,C为Ag,D为硝酸,E为NO,F为二氧化氮,
通过以上分析知,C、E、F分别是Ag、NO、NO2;
电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电生成银,所以其电解离子方程式为:4Ag+2H2O
| ||
电解时,溶液的pH由4变为1,则溶液中氢离子的物质的量=0.1mol/L×0.5L=0.05mol,
根据氢离子和氧气之间的关系式得氧气的体积=
| 0.05mol |
| 4 |
故答案为:Ag、NO、NO2;4Ag+2H2O
| ||
(2)若反应①和②需要在一定条件才能进行,A应为硫酸铜,结合转化关系可知,B为氧气,C为Cu,D为硫酸,E为二氧化硫,F为三氧化硫,
电解硫酸铜溶液时,阴极上铜离子放电生成铜,阳极上氢氧根离子放电生成氧气,所以阴极、阳极电极反应式分别为:2Cu2++4e-=2Cu、4OH--4e?=2H2O+O2↑;
铜、氧气和稀硫酸在加热条件下反应生成硫酸铜和水,反应方程式为2Cu+O2+2H2SO4
| ||
根据转移电子和生成氧气之间的关系式知,生成氧气的体积=
| 1mol |
| 4 |
故答案为:阴极:2Cu2++4e-=2Cu;阳极:4OH--4e?=2H2O+O2↑;2Cu+O2+2H2SO4
| ||
点评:本题考查了无机物的推断,明确物质的性质是解本题关键,根据离子的放电顺序确定电极产物,再结合题给信息进行分析解答,难度较大.

练习册系列答案
相关题目





