网址:http://m.1010jiajiao.com/timu_id_499232[举报]
1.D 2.A 3.A 4.C 5.C 6.AC 7.D 8.D 9.BD 10.AB 11.B
12.D 13.B 14.B 15.A 16.B 17.B 18.B 19.A 20.B 21.C 22.D
23.(1)< (2)右侧的3处
(3)< B相当于减压了,减压后平衡向 分解的方向移动,使B中
分解的方向移动,使B中 的量减少了.
的量减少了.
24.①提高,降低;②b=4;③ ;④
;④ 或
或 或ac+bc=ab
或ac+bc=ab
25.(1)B.根据反应:

 ,
,

 ,若要充分利用原料,显然要求原料与
,若要充分利用原料,显然要求原料与 反应产生的
反应产生的 和
和 物质的量之比等于或接近于3∶1,上述反应趋于恰好反应,原料得以充分利用.
物质的量之比等于或接近于3∶1,上述反应趋于恰好反应,原料得以充分利用. w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m




(2)①

 ②不合理.因为BiOCl中,Cl的化合价为-1价.③浓NaOH溶液中,
②不合理.因为BiOCl中,Cl的化合价为-1价.③浓NaOH溶液中, 抑制
抑制 的溶解,使
的溶解,使 的浓度减小,盐酸中
的浓度减小,盐酸中 抑制
抑制 的水解.
的水解.
26.(1)2、1、3、2 (2)A为气态,B为固态或气态,D为气态 (3)放热
27.(1)按1分钟计,生成0.5 mol C产生热量45 kJ,而容器散热
 ,所以应用加热器每分钟提供热量120
kJ-45 kJ=75 kJ
,所以应用加热器每分钟提供热量120
kJ-45 kJ=75 kJ
(2)容器半径和高度都变为原来10倍,则表面变为原来1000倍,平均每分钟生成C为0.5 mol×1000=500 mol,放出热量45000kJ,而容器散热12000 kJ,所以冷却器每分钟吸收热量45000 kJ-12000 kJ=33000 kJ
(3)不变
28.a=1 b=2
29.(1) (2)1/10500 (3)10
(2)1/10500 (3)10
30.①39% ②12.5% 31.(1)① 体积
体积
②当活塞由C向B移动时,因体积扩大使平衡:

 向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出
向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出



起始:0.08 mol 0
平衡:

因平衡时混合气体总的物质的量为0.07 mol,由于活塞由C移至B,体积扩大,故 ,可知充入
,可知充入 物质的量必小于0.01
mol
(2)
物质的量必小于0.01
mol
(2)
 www.ks5u.com
www.ks5u.com
.
|
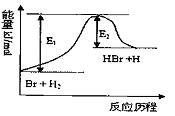 参照反应Br+H2
参照反应Br+H2 A.该反应的△H=+(E1-E2)kJ/mol
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量高于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
查看习题详情和答案>>
|
 HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )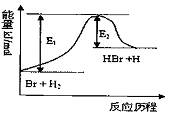
| A.该反应的△H=+(E1-E2)kJ/mol |
| B.加入催化剂,该化学反应的反应热变大 |
| C.反应物总能量高于生成物总能量 |
| D.升高温度可增大正反应速率,降低逆反应速率 |

已知:①高温条件下,烯烃与卤素单质发生取代反应;
②

请回答下列问题:
(1)写出A、C、E的结构简式:
A


(2)试剂①是
(3)请用系统命名法命名化合物F:
(4)写出满足下列条件的2,3-二氢呋喃的一种同分异构体的结构简式:
①没有支链,且一取代产物只有两种;
②与银氨溶液不发生银镜反应.
(5)如何将2,3-二氢呋喃变成四氢呋喃(
 )?请用化学方程式表示:
)?请用化学方程式表示: +H2
+H2| 催化剂 |

 +H2
+H2| 催化剂 |

(6)四氢呋喃还可由化合物G(C4H10O2)在少量浓硫酸存在下制得或由化合物H(C4H9ClO)在氢氧化钠溶液作用下制得,请分别写出化合物G和H的结构简式G
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]
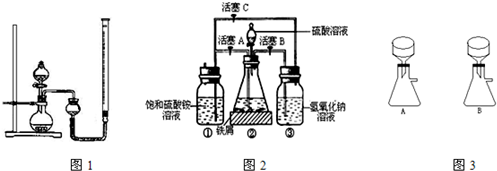
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
- 4 |
试求产品中摩尔盐的质量分数
 Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.(1)N2H4、N2O、NO、HNO2、N2O4、HNO3(
(2)CH4、C2H6、C3H8、C4H10、C5H12 (
(3)Ca、Mg、Fe、Cu、Pt (
Ⅱ. A、B、C、D、E为常见物质,已知A溶液为蓝色,B是一种碱,C是碱性氧化物,D和E为金属单质,回答:
(1)写出A、B、C的化学式:A
(2)写出下列各步的化学反应方程式:
A→B:
A→D:
Ⅲ.有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为
| ||
| ||
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为
| ||
| ||