摘要:如:
网址:http://m.1010jiajiao.com/timu_id_499199[举报]
1.B 2.B 3.B 4.B 5.A 6.BD 7.A 8.A 9.AD 10.A 11.AD
12.CD 13.C 14.A 15.B 16.D 17.D 18.C 19.A 20.B 21.A 22.B
23.(1)E、 、
、 (2)D、
(2)D、 、
、 (3)A、
(3)A、 、
、 (4)D、
(4)D、 、
、 .
.
24.①
②
③
④
25.(1)磺酸基 H亦有较强的酸性
H亦有较强的酸性 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
(2)A  (3)
(3)

26.(1) (2)
(2) (3)②⑤
(3)②⑤
(4)
n 

(2)①

②

(2)①②③④
29.


(2)可以,因为该反应的总反应式为 ,原子利用率=34/34×100%=100%,故可称为理想状态
,原子利用率=34/34×100%=100%,故可称为理想状态
30.(1)A、D (2)除去过量的硫粉 (3)
(4) 生成
生成 :
: ,∴ 未饱和
,∴ 未饱和
(5)B (6)设析出的晶体质量为x(g)
30×1.14-18.9=15.3(g) 
∴ x=23.1(g) www.ks5u.com
www.ks5u.com
如图是一套制取并验证氯气部分化学性质的实验装置.

回答下列问题:反应的方程式:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
(1)装置A中,仪器a的名称叫
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
(5)装置E的作用是
查看习题详情和答案>>

回答下列问题:反应的方程式:MnO2+4HCl(浓)
| ||
(1)装置A中,仪器a的名称叫
分液漏斗
分液漏斗
,该仪器中盛有的试剂为浓盐酸
浓盐酸
.(2)当Cl2气流通过一段时间后,装置B中溶液的pH值
<
<
7(填“>”“<”或“=”),写出Cl2与水反应的方程式Cl2+H2O═HCl+HClO
Cl2+H2O═HCl+HClO
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_
蓝色
蓝色
色,反应的离子方程式为Cl2+2I -=2Cl-+I2
Cl2+2I -=2Cl-+I2
.(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
不能,因为干燥的氯气没有漂白性
不能,因为干燥的氯气没有漂白性
.(5)装置E的作用是
吸收多余的氯气
吸收多余的氯气
. 如图所涉及的物质均为中学化学中的常见物质,其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如图转化关系,反应中生成的水及次要产物均已略去.
如图所涉及的物质均为中学化学中的常见物质,其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如图转化关系,反应中生成的水及次要产物均已略去.(1)写出化学式:B
HCl
HCl
,GFeCl2
FeCl2
.(2)指出MnO2在相关反应中的作用:
反应①中是
催化
催化
剂,反应②中是氧化
氧化
剂.(3)完成F与B 发生反应的化学方程式
Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
(4)若反应①是在加热条件下进行,A是
KClO3
KClO3
;若反应①是在常温条件下进行,A是
H2O2
H2O2
.若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为
2:1
2:1
.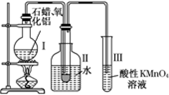 如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油.
如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油.资料1:石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态.
资料2:石油催化裂化中通常使用Al2O3作催化剂.
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图,实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液退色,实验后闻试管Ⅱ中液体气味,具有汽油的气味.
(1)该装置仪器连接的顺序遵循原则为
从下往上,从左往右
从下往上,从左往右
,为保证实验成功,实验前必须进行的操作是检查装置的气密性
检查装置的气密性
,装置中较长导管的作用是导气、冷凝气体
导气、冷凝气体
;(2)试管Ⅱ中少量液体凝结说明
裂化生成了含5个碳原子以上的烃
裂化生成了含5个碳原子以上的烃
;(3)试管Ⅲ中溶液退色说明裂化生成了碳原子数小于5的烯烃
裂化生成了碳原子数小于5的烯烃
;(4)能否用试管Ⅱ中的液体萃取溴水中的溴,
不能
不能
,理由是裂化产物中有烯烃,易与溴发生加成反应,
裂化产物中有烯烃,易与溴发生加成反应,
不能萃取溴
不能萃取溴
;(5)写出二十烷裂化得到癸烷和癸烯的化学方程式
C20H42
C10H22+C10H20
| ||
| △ |
C20H42
C10H22+C10H20
| ||
| △ |
(6)石油裂化的重要意义是
可提高石油产品中轻质燃油特别是汽油的产量和质量
可提高石油产品中轻质燃油特别是汽油的产量和质量
. 如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:
如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:(1)教材中是用与制O2相同的制备装置来加热制取NH3的,该反应的化学方程式为:
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
| ||
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
.
| ||
(2)下面是部分同学对于能用图1制取NH3的原因分析,有道理的是
①②③④
①②③④
.①在NH3?H2O中有平衡 NH3+H2O=NH3?H2O=NH4++OH-,NaOH使平衡向左移动; ②在NH3?H2O中有平衡阳NH3+H2O=NH3?H2O=NH4++OH-,NH4Cl 使平衡向左移动; ③NaOH 溶于水时放热,使体系的温度升高,NH3的溶解度减小;④NH4Cl与NaOH在此情况下可反应生成NH3,即NH4++OH-
| ||
(3)判断图1中烧瓶己收满NH3的现象
烧杯内的溶液变红
烧杯内的溶液变红
.(4)图2中胶头漓管中的水挤入烧瓶后,观察到的现象是
气球逐渐变大
气球逐渐变大
它说明了NH3极易溶于水
极易溶于水
.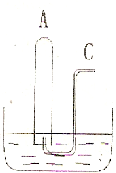 如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为
如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为3:1
3:1
;通过导气管C往余下0.5a mL 气体的试管A中持续通入氧气,A 中可能观察到的现象是:无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体
无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体
.当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为| 11 |
| 8 |
| 11 |
| 8 |
| a |
| 11200 |
| a |
| 11200 |



