摘要:20. . (2) (3)
网址:http://m.1010jiajiao.com/timu_id_495044[举报]
Ⅰ、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是
 .
.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1molP4时,就有
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol?L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol?L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是
mol.
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(4)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
□Ce3++□H2O2+□H2O═□Ce(OH)4↓+□
查看习题详情和答案>>
(1)磷元素的原子结构示意图是


(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1molP4时,就有
20
20
mol电子发生转移.(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol?L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol?L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是
| aV1-0.5bV 2 |
| 1000 |
| aV1-0.5bV 2 |
| 1000 |
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(4)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是
分解出HCl气体,抑制CeCl3的水解
分解出HCl气体,抑制CeCl3的水解
.(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
□Ce3++□H2O2+□H2O═□Ce(OH)4↓+□
H+
H+
.Ⅰ、A物质的化学式为M(OH)2,将其溶于水制成稀溶液,该溶液呈中性,在溶液中存在:
M2++2OH- M(OH)2
M(OH)2  2H++MO22-
2H++MO22-
回答以下题目一律用“增大”“减小”“不变”填空
(1)在其他条件不变的情况下,25C° 时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-)
(2)25C° 时,向A的稀溶液中加入少量的烧碱固体.则水的电离度
Ⅱ、.室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为
查看习题详情和答案>>
M2++2OH-
 M(OH)2
M(OH)2  2H++MO22-
2H++MO22-回答以下题目一律用“增大”“减小”“不变”填空
(1)在其他条件不变的情况下,25C° 时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-)
不变
不变
,C(H+)不变
不变
,水的电离度不变
不变
,Kw不变
不变
(2)25C° 时,向A的稀溶液中加入少量的烧碱固体.则水的电离度
减小
减小
,溶液的pH增大
增大
Ⅱ、.室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为
小于
小于
10 (填大于、等于或小于)Ⅰ、醉驾对人们的安全危害很大,利用下列原理可以检查司机是否酒后开车.
2K2Cr2O7(橙色)+3C2H5OH+H2SO4→Cr2(SO4)3(绿色)+K2SO4+CH3COOH+H2O
①配平化学方程式后,H2O前面的系数为
②怎样判断司机是酒后开车:
③写出用粮食酿酒的化学方程式:
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子.据此回答下列问题:

(1)A的组成是
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是
(3)A中某组分可由单质与水反应制得,化学方程式为:
(4)电解所用装置如图所示.
①电解开始阶段,阳极上的电极反应是
阴极上的电极反应是
②电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小
的顺序是
查看习题详情和答案>>
2K2Cr2O7(橙色)+3C2H5OH+H2SO4→Cr2(SO4)3(绿色)+K2SO4+CH3COOH+H2O
①配平化学方程式后,H2O前面的系数为
11
11
;②怎样判断司机是酒后开车:
将司机呼出的气体通入橙色溶液中,观察溶液颜色是否向绿色转变
将司机呼出的气体通入橙色溶液中,观察溶液颜色是否向绿色转变
.③写出用粮食酿酒的化学方程式:
(C6H10O5)n+nH2O
nC6H12O6,C6H12O6
2C2H5OH+2CO2↑
| ||
| ||
| 酵母菌 |
(C6H10O5)n+nH2O
nC6H12O6,C6H12O6
2C2H5OH+2CO2↑
.
| ||
| ||
| 酵母菌 |
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子.据此回答下列问题:

(1)A的组成是
Fe3O4、CuO
Fe3O4、CuO
(填化学式).(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是
Fe3+>Cu2+>H+>Fe2+(全对给分)
Fe3+>Cu2+>H+>Fe2+(全对给分)
.(3)A中某组分可由单质与水反应制得,化学方程式为:
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
(4)电解所用装置如图所示.

①电解开始阶段,阳极上的电极反应是
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
,阴极上的电极反应是
2 Fe3++2e-=2 Fe2+
2 Fe3++2e-=2 Fe2+
.②电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小
的顺序是
Fe2+>Cu2+
Fe2+>Cu2+
.Ⅰ、保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处.
(1)pH<
(2)对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为
(3)获得洁净安全的饮用水是每个人的正常需要.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为
Ⅱ、(1)下列常用物质:A.碳酸镁 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄(请用字母填空)
具有解热镇痛疗效的是
(2)①氢氧化铝,小苏打均可防治胃酸分泌过多,其发挥功效时的化学方程式
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)
③发育出现障碍,患营养缺乏症,这主要是由于摄入蛋白质不足引起的.蛋白质在人体内水解的最终产物是
查看习题详情和答案>>
(1)pH<
5.6
5.6
的雨水称为酸雨;向煤中加入适量的生石灰
生石灰
,可以大大减少燃物产物中SO2的量.(2)对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为
2CO+2NO
2CO2+N2
| ||
2CO+2NO
2CO2+N2
.
| ||
(3)获得洁净安全的饮用水是每个人的正常需要.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
.Ⅱ、(1)下列常用物质:A.碳酸镁 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄(请用字母填空)
具有解热镇痛疗效的是
B
B
,可直接进入人体血液补充能量的是C
C
,可用作食品防腐剂的是D
D
,常用作食品着色剂的是E
E
,常用作治疗胃酸过多的抗酸剂的是A
A
.(2)①氢氧化铝,小苏打均可防治胃酸分泌过多,其发挥功效时的化学方程式
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3HCl=AlCl3+3H2O
;NaHCO3+HCl=NaCl+CO2↑+H2O
NaHCO3+HCl=NaCl+CO2↑+H2O
.②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)
C6H12O6
C6H12O6
.③发育出现障碍,患营养缺乏症,这主要是由于摄入蛋白质不足引起的.蛋白质在人体内水解的最终产物是
氨基酸
氨基酸
. Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:
Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:正极:
2O2+8H++8e-=4H2O
2O2+8H++8e-=4H2O
负极:
CH4+2H4O-8e-=CO2+8H+
CH4+2H4O-8e-=CO2+8H+
总反应:
CH4+2O4=CO2+2H2O
CH4+2O4=CO2+2H2O
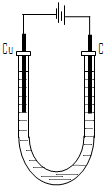
Ⅱ、如图所示,A、F为石墨电极,B、E为铁片电极.
按要求回答下列问题.
(1)打开K2,合并K1.
①B为
负
负
极,A极的电极反应为:O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
②最终可观察到的现象是:
溶液中有红褐色沉淀生成
溶液中有红褐色沉淀生成
③涉及的两个主要的化学反应的化学方程式为:
2Fe+O2+2H2O=2Fe(OH)2;4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe+O2+2H2O=2Fe(OH)2;4Fe(OH)2+O2+2H2O=4Fe(OH)3
(2)打开K1,合并K2.
①E为
阴
阴
极,F极的电极反应为:2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
②检验F极产生气体的方法是:
用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气
用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是
A、E
A、E
,原因是:(在下表中填写,可不填满)| 周围变红的电极代号(填字母) | 原因 |
A A |
O2+2H2O+4e-=4OH-,产生OH- O2+2H2O+4e-=4OH-,产生OH- |
E E |
2H++2e-=H2↑ H+反应,促进了水的电离,溶液中c(OH-)>c(H+) 2H++2e-=H2↑ H+反应,促进了水的电离,溶液中c(OH-)>c(H+) |
无 无 |
无 无 |
无 无 |
无 无 |