摘要:19.D(2)试剂:维生素C.FeCl3溶液 实验过程:把一粒维生素C投入盛有FeCl3溶液的小试管中.现象:FeCl3溶液的黄棕色退去.
网址:http://m.1010jiajiao.com/timu_id_495037[举报]
维生素C又名抗坏血酸,易溶于水,易被氧化,能与碘反应。人体缺乏维生素C可能引发多种疾病。某研究性学习小组对它研究如下:
猜想:维生素C可能具有酸性。
(1)实验方案:提供试剂:维生素C片、蒸馏水、紫色石蕊试液、无色酚酞试液、稀盐酸、氢氧化钠溶液、氯化钡溶液、pH试纸。根据以上试剂,请你帮助他们设计出实验方案,并写出实验现象:
猜想:维生素C可能具有酸性。
(1)实验方案:提供试剂:维生素C片、蒸馏水、紫色石蕊试液、无色酚酞试液、稀盐酸、氢氧化钠溶液、氯化钡溶液、pH试纸。根据以上试剂,请你帮助他们设计出实验方案,并写出实验现象:

(2)结论:维生素C具有酸性。根据维生素C的性质,判断下列物质中能与维生素C反应的是_________
A.金属镁 B.食盐 C.氢氧化钠 D.硫酸铜
(3)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,放置时间长短是否对维生素C的含量产生影响?他设计了如下
实验方案:
I.把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个烧杯中;
Ⅱ,取两支盛有2mL蓝色碘的淀粉溶液的试管,分别往其中滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录所用两种汁液的滴数如下
A.金属镁 B.食盐 C.氢氧化钠 D.硫酸铜
(3)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,放置时间长短是否对维生素C的含量产生影响?他设计了如下
实验方案:
I.把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个烧杯中;
Ⅱ,取两支盛有2mL蓝色碘的淀粉溶液的试管,分别往其中滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录所用两种汁液的滴数如下

你认为西红柿中维生素C含量高的是__________________
查看习题详情和答案>>
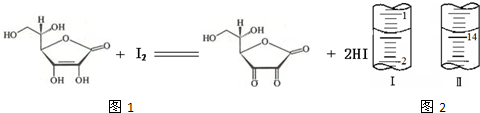
维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定.维生素C通常用标准I2溶液(I2在水中溶解度很小,易溶于KI溶液,I2+I- I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
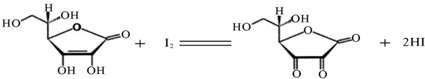
(1)滴定过程中应选用
(2)待测维生素C溶液在配制过程中,可以加入下列试剂中的
A.0.1mol?L-1CH3COOHB.0.1mol?L-1 HNO3
C.0.1mol?L-1NaOH D.0.1mol?L-1Na2SO3
(3)配制一定物质的量浓度的标准I2溶液所需玻璃仪器有
A.容量瓶 B.胶头滴管 C.玻璃棒 D.烧杯 E.量筒
(4)将1.0g 维生素样品制成100mL溶液,取25mL用0.1mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图,则样品中维生素C的质量分数为
查看习题详情和答案>>
 I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下: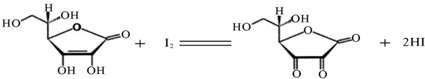
(1)滴定过程中应选用
酸式
酸式
(填酸式或碱式)滴定管盛放标准I2溶液,滴定所用的指示剂为淀粉溶液
淀粉溶液
,出现溶液的蓝色刚好出现,保持半分钟不变色
溶液的蓝色刚好出现,保持半分钟不变色
现象时即为滴定终点.(2)待测维生素C溶液在配制过程中,可以加入下列试剂中的
A
A
(填字母)A.0.1mol?L-1CH3COOHB.0.1mol?L-1 HNO3
C.0.1mol?L-1NaOH D.0.1mol?L-1Na2SO3

(3)配制一定物质的量浓度的标准I2溶液所需玻璃仪器有
ABCDE或ABCD
ABCDE或ABCD
(填字母)A.容量瓶 B.胶头滴管 C.玻璃棒 D.烧杯 E.量筒
(4)将1.0g 维生素样品制成100mL溶液,取25mL用0.1mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图,则样品中维生素C的质量分数为
88%
88%
.维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定.维生素C通常用标准I2溶液(I2在水中溶解度很小,易溶于KI溶液,I2+I- I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如图1所示:
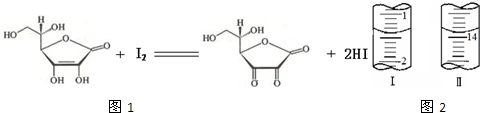
(1)滴定选用
(2)待测维生素C溶液应在
A、0.1mol?L-1 CH3COOH B、0.1mol?L-1 HNO3 C、0.1mol?L-1 NaOH D、0.1mol?L-1 Na2SO3
(3)不能用配制一定物质的量浓度的溶液方法精确配制标准I2溶液,其原因是
A.I2易升华,无法准确称量 B.I2易被空气氧化
C.I2的溶解度太小,无法制成溶液 D.加入的KI会影响滴定结果
(4)将1.0 g 维生素样品制成的100 mL溶液,取25 mL用0.1 mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图2,则样品中维生素C的质量分数为
查看习题详情和答案>>

(1)滴定选用
酸式
酸式
(填酸式或碱式)滴定管,滴定所用的指示剂为淀粉溶液
淀粉溶液
,出现溶液的蓝色刚好出现,保持半分钟不变色
溶液的蓝色刚好出现,保持半分钟不变色
现象时即为滴定终点.(2)待测维生素C溶液应在
酸性
酸性
(填酸性可碱性)介质中配制,可以选择试剂A
A
(填字母)A、0.1mol?L-1 CH3COOH B、0.1mol?L-1 HNO3 C、0.1mol?L-1 NaOH D、0.1mol?L-1 Na2SO3
(3)不能用配制一定物质的量浓度的溶液方法精确配制标准I2溶液,其原因是
A
A
(填字母)A.I2易升华,无法准确称量 B.I2易被空气氧化
C.I2的溶解度太小,无法制成溶液 D.加入的KI会影响滴定结果
(4)将1.0 g 维生素样品制成的100 mL溶液,取25 mL用0.1 mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图2,则样品中维生素C的质量分数为
88%
88%
.维生素C又名抗坏血酸,易溶于水,易被氧化,能与碘反应。人体缺乏维生素C可能引发多种疾病。某研究性学习小组对它研究如下:
(1)猜想:维生素C可能具有酸性?
(2)实验方案:
提供试剂:维生素C片、蒸馏水、紫色石蕊试液、无色酚酞试液、稀盐酸、氢氧化钠溶液、氯化钡溶液、pH试纸。
根据以上试剂,请你帮助他们设计出实验方案,并写出实验现象:
| 实验内容 | 实验现象 |
| 方案Ⅰ:将维生素C片溶于蒸馏水配成溶液,向其中滴加石蕊试液 | |
| 方案Ⅱ: |
(3)结论:维生素C具有酸性。根据维生素C的性质,判断下列物质中能与维生素C反应的是__________。
A.金属镁 B.食盐 C.氢氧化钠 D.硫酸铜
(4)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,放置时间长短是否对维生素C的含量产生影响。他设计了如下实验方案:
Ⅰ.把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个烧杯中;
Ⅱ.取两支盛有2 mL蓝色碘的淀粉溶液的试管,分别滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录滴数如下:
| 汁液 | 新鲜西红柿的汁液 | 放置一周的西红柿的汁液 |
| 滴数 | 12 | 20 |
你认为西红柿中维生素C含量高的是__________。
查看习题详情和答案>>