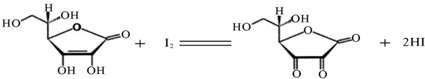题目内容
维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定.维生素C通常用标准I2溶液(I2在水中溶解度很小,易溶于KI溶液,I2+I- I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如图1所示:
(1)滴定选用
(2)待测维生素C溶液应在
A、0.1mol?L-1 CH3COOH B、0.1mol?L-1 HNO3 C、0.1mol?L-1 NaOH D、0.1mol?L-1 Na2SO3
(3)不能用配制一定物质的量浓度的溶液方法精确配制标准I2溶液,其原因是
A.I2易升华,无法准确称量 B.I2易被空气氧化
C.I2的溶解度太小,无法制成溶液 D.加入的KI会影响滴定结果
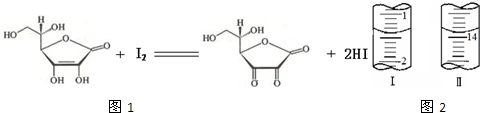
(4)将1.0 g 维生素样品制成的100 mL溶液,取25 mL用0.1 mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图2,则样品中维生素C的质量分数为

(1)滴定选用
酸式
酸式
(填酸式或碱式)滴定管,滴定所用的指示剂为淀粉溶液
淀粉溶液
,出现溶液的蓝色刚好出现,保持半分钟不变色
溶液的蓝色刚好出现,保持半分钟不变色
现象时即为滴定终点.(2)待测维生素C溶液应在
酸性
酸性
(填酸性可碱性)介质中配制,可以选择试剂A
A
(填字母)A、0.1mol?L-1 CH3COOH B、0.1mol?L-1 HNO3 C、0.1mol?L-1 NaOH D、0.1mol?L-1 Na2SO3
(3)不能用配制一定物质的量浓度的溶液方法精确配制标准I2溶液,其原因是
A
A
(填字母)A.I2易升华,无法准确称量 B.I2易被空气氧化
C.I2的溶解度太小,无法制成溶液 D.加入的KI会影响滴定结果
(4)将1.0 g 维生素样品制成的100 mL溶液,取25 mL用0.1 mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图2,则样品中维生素C的质量分数为
88%
88%
.分析:(1)碘液的氧化性导致碱式滴定管下面的胶管被氧化;根据I2遇淀粉变蓝,用淀粉指示滴入的碘是否过量;根据溶液的蓝色刚好出现,保持半分钟不变色来指示终点的到达;
(2)根据维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定;
(3)根据碘的物理性质进行分析;
(4)根据维生素C与I2的关系式求出维生素C的物质的量,然后再求出质量以及质量分数.
(2)根据维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定;
(3)根据碘的物理性质进行分析;
(4)根据维生素C与I2的关系式求出维生素C的物质的量,然后再求出质量以及质量分数.
解答:解:(1)因为碘溶液的氧化性,在碱式滴定管中易腐蚀旋塞,所以用酸式滴定管存放;I2遇淀粉变蓝,用淀粉指示滴入的碘是否过量,所以用淀粉溶液作指示剂;根据溶液的蓝色刚好出现,保持半分钟不变色来指示终点的到达;
故答案为:酸式;淀粉溶液;溶液的蓝色刚好出现,保持半分钟不变色.
(2)维生素具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定,所以待测维生素C溶液应在酸性介质中配制;
A.0.1mol?L-1CH3COOH溶液呈酸性,能将维生素C溶液在配制过程中加入到该试剂中,故A正确;
B.0.1mol?L-1 HNO3虽然呈酸性,但同时HNO3具有强氧化性,能将维生素C氧化,故B错误;
C、0.1mol?L-1NaOH呈碱性,维生素C在碱性溶液中易被空气氧化,故C错误;
D.0.1mol?L-1Na2SO3水解呈碱性,维生素C在碱性溶液中易被空气氧化,故D错误;
故答案为:酸性;A;
(3)由于I2易升华,无法准确称量碘的质量,所以不能用配制一定物质的量浓度的溶液方法精确配制标准I2溶液,
故选A;
(4)消耗I2溶液的体积为:13.90ml-1.40ml=12.50ml,
根据题中反应可知关系式:维生素C~I2
0.00125mol 0.0125l×0.1mol?L-1
则100mL溶液中含维生素C:0.00125mol×4=0.005mol,质量为:0.005mol×176g/mol=0.88g,
样品中维生素C的质量分数为
×100%=88%,
故答案为:88%.
故答案为:酸式;淀粉溶液;溶液的蓝色刚好出现,保持半分钟不变色.
(2)维生素具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定,所以待测维生素C溶液应在酸性介质中配制;
A.0.1mol?L-1CH3COOH溶液呈酸性,能将维生素C溶液在配制过程中加入到该试剂中,故A正确;
B.0.1mol?L-1 HNO3虽然呈酸性,但同时HNO3具有强氧化性,能将维生素C氧化,故B错误;
C、0.1mol?L-1NaOH呈碱性,维生素C在碱性溶液中易被空气氧化,故C错误;
D.0.1mol?L-1Na2SO3水解呈碱性,维生素C在碱性溶液中易被空气氧化,故D错误;
故答案为:酸性;A;
(3)由于I2易升华,无法准确称量碘的质量,所以不能用配制一定物质的量浓度的溶液方法精确配制标准I2溶液,
故选A;
(4)消耗I2溶液的体积为:13.90ml-1.40ml=12.50ml,
根据题中反应可知关系式:维生素C~I2
0.00125mol 0.0125l×0.1mol?L-1
则100mL溶液中含维生素C:0.00125mol×4=0.005mol,质量为:0.005mol×176g/mol=0.88g,
样品中维生素C的质量分数为
| 0.88g |
| 1.0g |
故答案为:88%.
点评:本题主要考查了滴定操作以及误差分析、计算,需要注意的是淀粉可作标准I2溶液滴定维生素C的指示剂,本题难度中等.

练习册系列答案
相关题目
维生素C(C6H8O6)是人体必需的营养物质,它属于( )
| A、单质 | B、氧化物 | C、有机物 | D、无机物 |
 I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下: