网址:http://m.1010jiajiao.com/timu_id_495016[举报]
①在中性或弱酸性介质中先用过量的Br2,将试样中的I-氧化成![]() ;
;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将![]() 还原为I2;
还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2====2NaI+Na2S4O6)。
通过上述步骤可测得碘化物中I-的含量:
(1)写出步骤①②中发生反应的离子方程式:
①__________________________________________,
②__________________________________________。
(2)若样品中有1 mol I-,则最后耗用Na2S2O3的物质的量是多少?
(3)若在测定时,准确量取含KI的样品溶液25.00 mL,终点时耗用0.050 mol·L-1 Na2S2O3溶液20.06 mL,试计算样品溶液中KI的含量(g·L-1)。
查看习题详情和答案>>少量的碘化物可用以下方法进行测定,其步骤如下:
①在中性或弱酸性介质中先用过量的Br2,将试样中的I-氧化成![]() ;
;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将![]() 还原为I2;
还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2====2NaI+Na2S4O6)。
通过上述步骤可测得碘化物中I-的含量:
(1)写出步骤①②中发生反应的离子方程式:
①__________________________________________,
②__________________________________________。
(2)若样品中有1 mol I-,则最后耗用Na2S2O3的物质的量是多少?
(3)若在测定时,准确量取含KI的样品溶液25.00 mL,终点时耗用0.050 mol·L-1 Na2S2O3溶液20.06 mL,试计算样品溶液中KI的含量(g·L-1)。
查看习题详情和答案>>①在中性或弱酸性介质中先用过量的Br2将样品中的I-氧化成IO3-;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将IO3- 还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)。
通过上述步骤可测得碘化物中I-的含量。
要求:
(1)写出步骤①②中发生反应的离子方程式。
(2)若样品中有1mol I-,则最后耗用Na2S2O3的物质的量是多少?
(3)若在测定时,准确量取含KI的样品溶液25.00mL,终点时耗用0.100mol/LNa2S2O3溶液20.06mL,试计算样品溶液中KI的含量(g/L)。
查看习题详情和答案>>
(1)仪器A的名称
(2)如果某试管中有上下两层,均呈无色,采取什么办法判断哪一层是水溶液?
(3)写出离子方程式:步骤①
(4)滴定时,
II、Ag+浓度为0.100mol?L-1的溶液5mL,加入等物质的量的某碱金属盐,充分反应后生成卤化物沉淀,经过滤、洗涤后在200W灯泡下烘干,得到1.297×10-2 g固体.
(5)如果卤化物沉淀为AgX,则其物质的量为
(6)如果卤化物沉淀为碱金属卤化物,其摩尔质量为
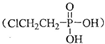 ,D在弱酸性条件下会缓慢释放出A.合成D的一种方法及各物质间转化关系如下图所示:
,D在弱酸性条件下会缓慢释放出A.合成D的一种方法及各物质间转化关系如下图所示:
请回答下列问题:
(1)A的名称是
(2)经测定E中含有氯元素,且E可以与乙酸发生酯化反应,则E的结构简式为
(3)在弱酸性条件下,D与水反应生成A的化学方程式为
 +H2O
+H2O| 弱酸 |
 +H2O
+H2O| 弱酸 |
(4)写出E的两个同分异构体的结构简式