网址:http://m.1010jiajiao.com/timu_id_493669[举报]
| A.氯化氢的摩尔质量等于NA个氯分子和NA个氢分子的质量之和 |
B.常温常压下1 mol NO2气体与水反应生成NA个NO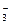 离子 离子 |
| C.121 g CCl2F2所含的氯原子个数为2NA |
D.62 g Na2O溶于水后所得溶液中含有O 离子数为NA 离子数为NA |
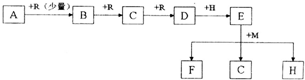
请回答下列问题:
(1)实验室快速制取少量R的方程式为
| ||
| ||
(2)若F溶于水得到蓝色溶液,则M为
| ||
| ||
(A)V<10.08
(B)因为M为足量,可以计算出被还原的E的物质的量为0.45mol
(C)被氧化的M的质量为
| 20V |
| 7 |
(D)若将生成的气体C通入紫色石蕊试液中,溶液先变红,最终褪为无色.
(E)可以用BaCl2溶液来检验最终溶液中E有无剩余.
(3)若M为短周期元素形成的黑色固体单质,实验室利用下图装置检验E和M在加热条件下反应所得全部产物.
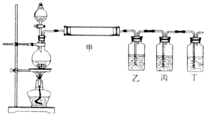
①装置甲中应加的试剂是
②装置乙、丙和丁中所加试剂分别是
(A)澄清石灰水、品红溶液、高锰酸钾酸性溶液
(B)品红溶液、高锰酸钾酸性溶液、澄清石灰水
(C)澄清石灰水、高锰酸钾酸性溶液、品红溶液
③在实验中如果将丙去掉,
④如果将烧瓶中产生的气体混合物分别通入Ba(NO3)2溶液和BaCl2溶液中,二者现象
相同(4)若M为短周期元素形成的单质,用它制作的容器在常温下能够盛放E的浓溶液.请写出M的单质与E的浓溶液剧烈反应的化学方程式
| ||
| ||
直接生成碳-碳键的反应是实现高效、绿色有机合成的重要途径。交叉脱氢偶联反应是近年备受关注的一类直接生成碳-碳键的新反应。例如:
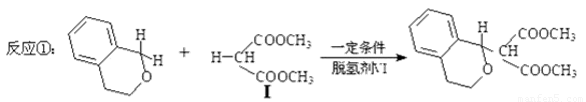
化合物Ⅰ可由以下合成路线获得:
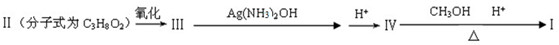
(1)化合物Ⅰ的分子式为___________,其在NaOH溶液中水解的化学方程式为_________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)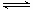 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。

查看习题详情和答案>>
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。

回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
(4)由表中数据判断ΔH 0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是 。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为 ;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数 (填“变大”、“变小”、或“不变”)。
查看习题详情和答案>>
化学反应变化过程及结果的研究。按要求回答问题:
(1)关于反应过程中能量变化的研究:

则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2
(l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH _______0 (填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。

③上图中的B点处,NH3的平衡转化率为 。
(3)关于电化学的研究:
铝是日常生活中用途最多的金属元素,下图为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝电极反应式为 。用该电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。


(4)关于电离平衡的研究:
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
|
c(HCO3-) ∶c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
|
pH |
6.10 |
7.35 |
7.40 |
7.45 |
试回答:
正常人体血液中,HCO3-的水解程度 电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射缓解 (填选项);
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③ pH=7.00的血液中,c(H2CO3) c(HCO3-) (填“<”、“>”、“=”)
查看习题详情和答案>>