题目内容
化学反应变化过程及结果的研究。按要求回答问题:
(1)关于反应过程中能量变化的研究:

则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2
(l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH _______0 (填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。

③上图中的B点处,NH3的平衡转化率为 。
(3)关于电化学的研究:
铝是日常生活中用途最多的金属元素,下图为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝电极反应式为 。用该电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。


(4)关于电离平衡的研究:
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
|
c(HCO3-) ∶c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
|
pH |
6.10 |
7.35 |
7.40 |
7.45 |
试回答:
正常人体血液中,HCO3-的水解程度 电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射缓解 (填选项);
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③ pH=7.00的血液中,c(H2CO3) c(HCO3-) (填“<”、“>”、“=”)
(1)-a+2b-4c(2分)
(2)① < (2分) ②c(NH3)增大,平衡正向移动(2分) ③32% (3分)
(3)Al+4OH-―3e-=AlO2-+2H2O(2分) CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O (2分)
(4)①大于(1分); ②B(1分) ③<(1分)
【解析】
试题分析:(1) 运用盖斯定律,可得要求化学反应的∆H=∆H1-2∆H2+4∆H3。
(2)①随着温度升高,平衡常数K逐渐减少,所以正反应为放热反应,∆H<0。
②c(NH3)增大,平衡正向移动,CO2的转化率增大。
③B点氨碳比为4.0,设氨的物质的量为4n,CO2的物质的量为n,则转化的CO2为0.64n,根据化学方程式可得转化的氨为1.28n,则氨的转化率为:1.28n÷4n×100%=32%
(3)Al在OH‾存在条件下失去3e‾, 生成AlO2-,根据图(3)可以看出阳极产生N2,CO(NH2)2中的C转化为CO32‾,H与OH‾转化为H2O,配平可得电极方程式。
(4)正常人体血液pH保持在7.35~7.45,所以HCO3‾的水解程度大于电离程度,HCO3‾能调节pH,起到缓冲作用,所以选B NaHCO3溶液,因为等浓度的H2CO3的电离程度大于HCO3‾的水解程度,血液的pH为7.00,则H2CO3的程度小于H CO3‾的程度。
考点: 本题考查盖斯定律、化学平衡移动、转化率的计算、电极方程式的书写和电解质溶液的电离和水解。

以下是对化学反应变化过程及结果的研究。按要求回答问题:
Ⅰ.关于反应速率和限度的研究
(1)已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则等物质的量浓度的①CH3COONa、②NaCN、③Na2CO3、④NaHCO3溶液的pH由大到小的顺序为__________(填编号)。
(2)已知2SO2(g)+O2(g)??2SO3(g) ΔH=-196.6 kJ·mol-1,在一个容积为2 L的容器中加入2 mol SO2和1 mol O2,在某温度下充分反应,经过30 min达到平衡,放出热量176.94 kJ。如果用SO2表示该反应的反应速率,则v(SO2)=________。
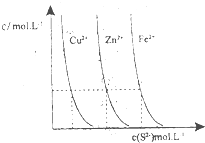
(3)下图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是________。

向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为________(填化学式)沉淀。
Ⅱ.关于电化学的研究
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:VO2++2H++V2+ V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。


 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题: