网址:http://m.1010jiajiao.com/timu_id_4747[举报]
1、B 2、A 3、B 4、D 5、B
6、C 7、C 8、B 9、BD 10、B 11、C 12、BD 13、B 14、AD 15、C
16、(8分) ⑴ ②④ (4分,选对一个得2分,错选不给分) ⑵ ①不漏气(1分)②不能确定(1分)
不管装置是否漏气,烧瓶内气压与漏斗上方气压相等,水在重力作用下可流入烧瓶(2分)
17、(14分)(1)H、I、C(或D)、D(或C)、A(或B) (2分)
(2)吸收产生的水蒸气;吸收乙炔中的水蒸气.(每空2分)
(3)
(每空2分)
(4) Ⅰ装置吸收了空气中水和二氧化碳 (每空2分)
18 (10分)(1)
(2) b ; 降低了合成氨反应的活化能
(3) C
⑷ ②③ (每空2分)
19.(12分)(1)H2O(1分) ;在H2O 分子之间存在着氢键的作用(1分)
(2)H++HSO3―=H2O+SO2↑ (2分)
(3) (2分) 离子键、非极性键 (2分)
(4) 阴(1分);2Cl--2e-=Cl2↑(1分);
湿润的淀粉碘化钾试纸(2分)(其他合理答案均可给分);
20(10分)(1)A:S B:H2S D:SO3 (每空1分)
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O (2分)
(2) A:N2 B:NH3 D:N02 (每空1分)
3Cu+8H++2NO3-=3Cu2++2NO↑十4H20 (2分)
五、
21.(8分)(1)8(2分) (2)C、D(2分,每选一个正确的得1分,错选不给分)
22.(10分,每空2分)
(1)A.CH≡CCH=CH2 E.CH≡CCH2OH
(2)CH2=CHCH=CH2+Br2→CH2BrCH=CHCH2Br
⑶CH≡CH CH2=CH2 CH2Br-CH2Br CH2OH-CH2 OH
(其他合理答案也给分)
六、
23.(8分)
⑴ 439.22L (或439L)(2分) 12.94mol/L (或13mol/L )(2分)
⑵ n(SO2)= (1×104×103L×0.2% )/(22.4 L/mol)=892.86mol
m(NH3)=892.86mol×2×17g/mol = 30357.24 g
∴m(氨水)= 30357.24 g/(25%)×10-6t/g= 0.12吨 (4分)
24.(10分,每空2分,绘图2分)
x取值
y=f(x)
0<x≤3
y=2x/3
3<x<3.2
y=32-10x
(1)工业上有一种方法是用CO2来生产燃料甲醇.298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如图所示,据图回答问题:

①写出合成甲醇反应的热化学方程式
 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1②在图中曲线
③在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.

从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
该反应的平衡常数k=
| 16 |
| 3 |
| 16 |
| 3 |
(2)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
 ①温度升高,K值
①温度升高,K值②提高氢碳比[n(H2)/n(CO2)],K值
③在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响.并对图中横坐标、纵坐标的含义作必要的标注.

合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金网.请回答下列问题:
(1)1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图2所示.
 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是(2)合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g),写出该反应的化学平衡常数表达式K=
| c2(NH3) |
| c(N2).c3(H2) |
| c2(NH3) |
| c(N2).c3(H2) |
(3)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1 266.8kJ/mol
N2(g)+O2(g)=2NO(g)△H=+1 80.5kJ/mol,氨催化氧化的热化学方程式为
(4)吸收塔中通入空气的目的是
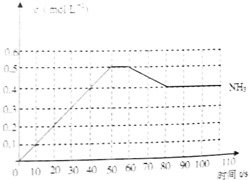 哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖,N2(g)+3H2(g)
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖,N2(g)+3H2(g)| 催化 |
(1)此反应在50~60s时化学平衡常数为K1=
| 0.52 |
| 2.253×0.75 |
| 0.52 |
| 2.253×0.75 |
(2)反应进行到60s时,改变的条件可能是
A.加入催化剂 B.扩大容器的体积
C.升高温度 D.减小氨气的浓度
在该条件下,氮气的化学反应速率
(3)该反应在80S后化学平衡常数为K2,则K1
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数
