网址:http://m.1010jiajiao.com/timu_id_453387[举报]
(1)①在50 s内,甲容器中O2的化学反应速率为_____________,甲容器达到平衡时SO2的转化率是_____________。
②乙容器达到平衡时所需时间_____________50 s(填“大于”“小于”或“等于”)。
(2)达到平衡状态后,要使甲、乙两容器中SO2物质的量相等,可采取的措施是_____________(填字母)。
A.保持温度不变,适当扩大甲容器的容积
B.保持容积不变,使乙容器升温
C.保持容积和温度不变,向乙容器中加入适量SO3(g)
D.保持容积和温度不变,向甲容器中加入适量SO3(g)
查看习题详情和答案>>例:将2.0mol SO2气体和2.0mol SO3气体混合于固定容积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
A. 1.6mol SO2+0.3mol O2+0.4mol SO3
B. 4.0mol SO2+1.0mol O2
C. 2.0mol SO2+1.0mol O2+2.0mol SO3
D. 3.0mol SO2+1.0mol O2+1.0mol SO3
查看习题详情和答案>>向某起始体积为2 L的密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如1图所示.图2为t2时刻后改变容器中条件平衡体系中速率随时间变化的情况,且四个阶段都各改变一个条件,所用条件均不同.已知t3~t4阶段为使用催化剂.

(1)若t1=15 s,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=________.
(2)若t2~t3阶段,C的体积分数变小,此阶段v(正)________v(逆)(填“>”、“=”、“<”).
(3)t4~t5阶段改变的条件为________,B的起始物质的量为________.
(4)t5~t6阶段容器内A的物质的量共减小0.03 mol,而此过程中容器与外界的热交换总量为a kJ,写出该反应的热化学方程式:________.
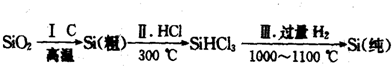
(1)无机非金属材料.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
①写出步骤I的化学方程式:
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是
(2)磁性材料.这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的使用开始就不断实施着对它的防护.最常见的铁制品腐蚀就是电化学腐蚀,请写出最为普遍的电化学腐蚀的负极反应式:
(3)激光材料.我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:
(4)高分子材料.它可以分成无机高分子材料和有机高分子材料.一种新型高效净水剂[AlFe(OH)nCl6-n]m就属于无机高分子材料,它广泛应用生活用水和工业污水的处理,其中铁元素的化合价为
(5)合金材料.14g铜银合金与一定量某浓度的硝酸完全反应后,将放出的气体与1.12L(标准状况下)O2混合通入水中,恰好全部被水吸收,则合金中铜的质量为
(1)T℃时,一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)
 CO2(g) +H2(g) △H=-42KJ/mol
CO2(g) +H2(g) △H=-42KJ/mol ①下列事实能说明该反应达到平衡的是_________
a.体系中的压强不发生变化
b.υ正(H2)=υ逆(CO )
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
② T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表

(2)CO可以合成二甲醚,二甲醚可作为燃料电池的,已知参与电极反应的单位质量电极材料放出电能的大小称为该电池的比能量,则二甲醚碱性燃料电池与乙醇碱性燃料电池相比较,下列说法正确的是____________。(填字母)
A、两种燃料互为同分异构体,分子式相同,比能量相同
B、两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C、两种燃料所含共价键种类不同,断键时所需能量不同,比能量不同
(3)某有机物由C、H、Al三种元素组成,其摩尔质量为72 ,其中Al、C的质量分数分别为37.5%和50%。该物质与水剧烈反应生成CH4,则该反应的化学方程式为_____________。