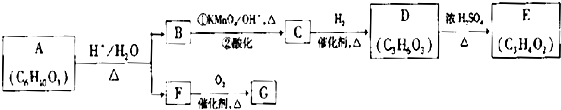
题目内容
【化学--选修2:化学与技术】“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请回答下列问题: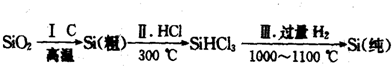
(1)无机非金属材料.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
①写出步骤I的化学方程式:
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是
(2)磁性材料.这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的使用开始就不断实施着对它的防护.最常见的铁制品腐蚀就是电化学腐蚀,请写出最为普遍的电化学腐蚀的负极反应式:
(3)激光材料.我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:
(4)高分子材料.它可以分成无机高分子材料和有机高分子材料.一种新型高效净水剂[AlFe(OH)nCl6-n]m就属于无机高分子材料,它广泛应用生活用水和工业污水的处理,其中铁元素的化合价为
(5)合金材料.14g铜银合金与一定量某浓度的硝酸完全反应后,将放出的气体与1.12L(标准状况下)O2混合通入水中,恰好全部被水吸收,则合金中铜的质量为
分析:(1)①焦炭在高温下可以置换二氧化硅中的硅;
②根据熔沸点的不同实现物质分离的方法为蒸馏或分馏;
(2)在铁制品腐蚀的电化学腐蚀中,金属铁作负极发生氧化反应;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,均放出氢气;
(4)AlFe(OH)nCl6-n中各元素的化合价代数和为0,丙烯腈(CH2=CH-CN)中的双键能发生加聚反应;
(5)铜、银合金与足量的某浓度的硝酸反应,硝酸所起作用为酸性和氧化性,起酸性作用的硝酸生成硝酸铜、硝酸银,起氧化性作用的硝酸被还原为氮的氧化物(无法确定具体物质),氮的氧化物与氧气混合通入水中,反应又生成硝酸,根据氮元素守衡,该硝酸的量恰好等于起氧化性作用的硝酸的量.所以有铜、银合金失去的电子总数等于氧气获得的电子总数.利用铜、银合金失去的电子总数等于氧气获得的电子总数以及铜、银合金总质量为14g,列方程求解.
②根据熔沸点的不同实现物质分离的方法为蒸馏或分馏;
(2)在铁制品腐蚀的电化学腐蚀中,金属铁作负极发生氧化反应;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,均放出氢气;
(4)AlFe(OH)nCl6-n中各元素的化合价代数和为0,丙烯腈(CH2=CH-CN)中的双键能发生加聚反应;
(5)铜、银合金与足量的某浓度的硝酸反应,硝酸所起作用为酸性和氧化性,起酸性作用的硝酸生成硝酸铜、硝酸银,起氧化性作用的硝酸被还原为氮的氧化物(无法确定具体物质),氮的氧化物与氧气混合通入水中,反应又生成硝酸,根据氮元素守衡,该硝酸的量恰好等于起氧化性作用的硝酸的量.所以有铜、银合金失去的电子总数等于氧气获得的电子总数.利用铜、银合金失去的电子总数等于氧气获得的电子总数以及铜、银合金总质量为14g,列方程求解.
解答:解:(1)①工业上用焦炭在高温下置换二氧化硅中的硅来制备粗硅,方程式为:SiO2+2C
Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑;
②SiHCl3(沸点33.0℃)、SiCl4(沸点57.6℃)、HCl(沸点-84.7℃),他们的沸点不同,根据沸点的不同实现物质分离的方法为蒸馏或分馏,故答案为:蒸馏或分馏;
(2)在铁制品的电化学腐蚀中,金属铁作负极发生氧化反应,电极反应为:Fe-2e-→Fe2+,故答案为:Fe-2e-→Fe2+;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,故答案为:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(4)化合物中铝元素显+3价,氢氧根为-1价,各元素的化合价代数和为0,故铁元素的化合价为+3价,丙烯腈(CH2=CH-CN)中的双键能发生加聚反应,方程式为: ,故答案为:+3;
,故答案为:+3; ;
;
(5)解:n(O2)=
=0.05mol
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g
根据电子守恒列方程:2x+1×y=0.05mol×4
解得:x=0.05mol;y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g,
故答案为:3.2g.
| ||
| ||
②SiHCl3(沸点33.0℃)、SiCl4(沸点57.6℃)、HCl(沸点-84.7℃),他们的沸点不同,根据沸点的不同实现物质分离的方法为蒸馏或分馏,故答案为:蒸馏或分馏;
(2)在铁制品的电化学腐蚀中,金属铁作负极发生氧化反应,电极反应为:Fe-2e-→Fe2+,故答案为:Fe-2e-→Fe2+;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,故答案为:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(4)化合物中铝元素显+3价,氢氧根为-1价,各元素的化合价代数和为0,故铁元素的化合价为+3价,丙烯腈(CH2=CH-CN)中的双键能发生加聚反应,方程式为:
 ,故答案为:+3;
,故答案为:+3; ;
;(5)解:n(O2)=
| 1.12L |
| 22.4L/mol |
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g
根据电子守恒列方程:2x+1×y=0.05mol×4
解得:x=0.05mol;y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g,
故答案为:3.2g.
点评:本题是一道有关硅的无机推断题,考查的知识点范围较广,涉及原电池、两性氧化物、高分子材料、氧化还原反应的计算等,题目难度较大.

练习册系列答案
相关题目
【化学--选修:物质结构与性质】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式: .
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 .
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为 .
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 ,其中心离子是 ,配位数为 .
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是 和 .
②T元素最可能是 区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 ,其中心原子的杂化方式为 .
(1)写出制备 NF3的化学反应方程式:
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是
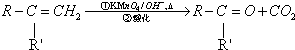 (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团)