网址:http://m.1010jiajiao.com/timu_id_45305[举报]
(12分)一定温度下,分别往容积均为5L的甲(恒容容器)、乙(恒压容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,测得甲容器中N2O4的浓度为0.09mol/L。经过60s,甲容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)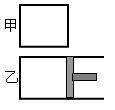
(1)容器中气体出现红棕色的原因(用化学方程式表示)
________________________________________________;
(2) 达到平衡时,乙容器中反应所需的时间______60s(填“>”、“<”或“=”,以下同);容器内N2O4的浓度甲__________乙;反应过程中吸收的能量甲_________乙。
(3)若要使甲、乙中N2O4的浓度相等,不能采取的措施是__________(填选项的标号)
A.保持温度不变,适当缩小乙容器的体积
B.保持容器体积不变,使乙容器升温
C.保持容器体积和温度不变,向乙容器中加入适量N2O4
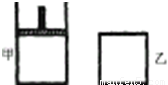
(1)容器中气体出现红棕色的原因(用化学方程式表示)是:______.
(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为______.
(3)达到平衡时,甲容器中反应所需的时间______ 60s(填“大于”、“小于”或“等于”,以下同);容器内N2O4的浓度甲______ 乙;反应过程中吸收的能量甲______ 乙.

(1)容器中气体出现红棕色的原因(用化学方程式表示)是: .
(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为 .
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,以下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙.
 查看习题详情和答案>>
查看习题详情和答案>>
如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol·L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
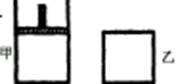
(1)容器中气体出现红棕色的原因(用化学方程式表示)是: 。(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为 。
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,以下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
查看习题详情和答案>>
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒。
汽车尾气净化的主要原理为:2NO(g)+2CO(g)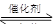 2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断: 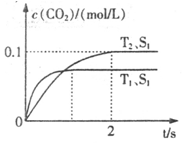
(1)该反应为 反应(填“放热”或“吸热”):在T2温度下,0~2s内的平均反应速率:v(N2)= ;(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0)。
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/xl0-4mol L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/xl0-3mol L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K= ,平衡时NO的体积分数为 。
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
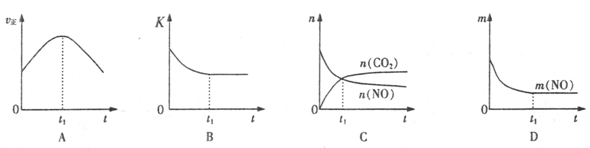
(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) △H=-867.0kJ ? mol-1
2NO2 (g)
 N2O4 (g) △H=-56.9kJ ? mol-1
N2O4 (g) △H=-56.9kJ ? mol-1H2O(g) = H2O(l) △H=-44.0kJ ? mol-1
写出CH4催化还原N2O4 (g)生成N2 (g)、CO2 (g)和H2O(l)的热化学方程式 。 查看习题详情和答案>>