摘要:配平下列化学方程式.并按要求填写空格. KMnO4+ HCl--- KCl+ MnCl2+ Cl2↑+ .(1).当有2molKMnO4被还原时.这时转移电子数为 .(2).氧化剂是 .氧化产物是 .参加反应的HCl与被氧化的HCl的物质的量之比是 .
网址:http://m.1010jiajiao.com/timu_id_45290[举报]
1)在Fe3O4+4CO
3Fe+4CO2的反应中,
2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目,
①还原性 ②酸性 ③氧化性?
查看习题详情和答案>>
| ||
四氧化三铁
四氧化三铁
是氧化剂,一氧化碳
一氧化碳
是还原剂,碳
碳
元素被氧化,铁
铁
元素被还原.2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目,
1
1
Cu+4
4
HNO3(浓)-1
1
Cu(NO3)2+2
2
NO2↑+2
2
H2O浓硝酸表现出来的性质是②③
②③
(填写编号).?①还原性 ②酸性 ③氧化性?
(2011?南开区二模)Ⅰ.高炉炼铁过程中发生的主要反应为:
Fe2O3(s)+CO(g)?
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
请回答以下问题:
(1)该反应的平衡常数表达式K=
,△H=
(2)在体积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡,该时间范围内反应的平均反应速度v(CO2)=
Ⅱ.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650mg/L.现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2═KOCN+2KCl+H2O,则被氧化的元素是
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯
查看习题详情和答案>>
| 1 |
| 3 |
| 2 |
| 3 |
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
<
<
0(填“>”、“<”或“=”).(2)在体积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡,该时间范围内反应的平均反应速度v(CO2)=
0.006mol/(L?min)
0.006mol/(L?min)
,CO的平衡转化率为60%
60%
.Ⅱ.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650mg/L.现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2═KOCN+2KCl+H2O,则被氧化的元素是
C
C
.(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
2
2
KOCN+4
4
KOH+3
3
Cl2═2
2
CO2+1
1
N2+6
6
KCl+2
2
H2O(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯
35.5
35.5
g.配平下列化学方程式
 .
.
查看习题详情和答案>>
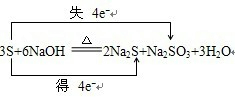
3
3
S+6
6
NaOH
| ||
2
2
Na2S+1
1
Na2SO3+3
3
H2O指出被氧化的元素是S
S
,被还原的元素是S
S
,氧化产物Na2SO3
Na2SO3
,还原产物Na2S
Na2S
,氧化剂与还原剂的质量比是2:1
2:1
并用双线桥表示该反应转移的电子方向和数目

1、亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:
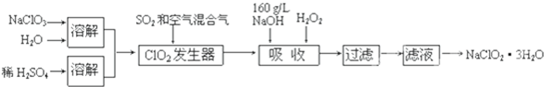
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g/L NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1L.
(1)160g/L NaOH溶液的物质的量浓度为:
(2)发生器中鼓入空气的作用是:
(3)吸收装置内发生反应的化学方程式为:
吸收装置中的温度不能过高,其原因是:
(4)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中.除H2O2外,还可以选择的还原剂是
(选填序号)a.Na2O2 b.Na2S c.FeCl2
(5)从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是
a.蒸发结晶 b.蒸发浓缩 c.灼烧 d.过滤 e.冷却结晶
2、在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐再进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650mg?L-1.现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O,再投入过量液氯,可将氰酸盐进一步氯化为氮气.请配平下列化学方程式:
(配平后请在方框内填写每种物质的化学计量数,若为“1”也要写上)
(2)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯
查看习题详情和答案>>

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g/L NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1L.
(1)160g/L NaOH溶液的物质的量浓度为:
4.00 mol/L
4.00 mol/L
(结果保留三位有效数字)(2)发生器中鼓入空气的作用是:
稀释ClO2,防止ClO2分解爆炸
稀释ClO2,防止ClO2分解爆炸
.(3)吸收装置内发生反应的化学方程式为:
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
;吸收装置中的温度不能过高,其原因是:
防止H2O2的分解
防止H2O2的分解
.(4)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中.除H2O2外,还可以选择的还原剂是
a
a
(选填序号)a.Na2O2 b.Na2S c.FeCl2
(5)从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是
b e d
b e d
(选填序号)a.蒸发结晶 b.蒸发浓缩 c.灼烧 d.过滤 e.冷却结晶
2、在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐再进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650mg?L-1.现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O,再投入过量液氯,可将氰酸盐进一步氯化为氮气.请配平下列化学方程式:
(配平后请在方框内填写每种物质的化学计量数,若为“1”也要写上)
2
2
KOCN+4
4
KOH+3
3
Cl2→2
2
CO2+1
1
N2+6
6
KCl+2
2
H2O(2)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯
35.5
35.5
g.