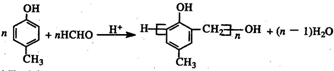
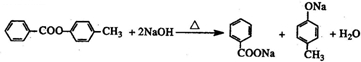题目内容
(2011?南开区二模)Ⅰ.高炉炼铁过程中发生的主要反应为:
Fe2O3(s)+CO(g)?
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
请回答以下问题:
(1)该反应的平衡常数表达式K=
,△H=
(2)在体积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡,该时间范围内反应的平均反应速度v(CO2)=
Ⅱ.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650mg/L.现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2═KOCN+2KCl+H2O,则被氧化的元素是
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯
| 1 |
| 3 |
| 2 |
| 3 |
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
<
<
0(填“>”、“<”或“=”).(2)在体积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡,该时间范围内反应的平均反应速度v(CO2)=
0.006mol/(L?min)
0.006mol/(L?min)
,CO的平衡转化率为60%
60%
.Ⅱ.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650mg/L.现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2═KOCN+2KCl+H2O,则被氧化的元素是
C
C
.(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
2
2
KOCN+4
4
KOH+3
3
Cl2═2
2
CO2+1
1
N2+6
6
KCl+2
2
H2O(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯
35.5
35.5
g.分析:Ⅰ(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、醇液体不需要写出;
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,据此判断;
(2)计算此时的浓度商Qc,判断反应进行分析,令参加反应的CO为amol,利用三段式用a表示出平衡时各组分的物质的量,反应前后气体的化学计量数不变,利用物质的量代替浓度代入平衡常数表达式列方程计算a的值,进而计算生成的二氧化碳,
根据v=
计算v(CO2);
根据转化率等于计算CO的平衡转化率;
Ⅱ、(1)化合价升高的元素被氧化;
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数;
(3)计算废水中KCN的质量,再根据n=
计算KCN的物质的量,使KCN完全转化为无毒物质,生成CO、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,根据电子转移守恒计算n(Cl2),再根据m=nM计算需要氯气的质量.
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,据此判断;
(2)计算此时的浓度商Qc,判断反应进行分析,令参加反应的CO为amol,利用三段式用a表示出平衡时各组分的物质的量,反应前后气体的化学计量数不变,利用物质的量代替浓度代入平衡常数表达式列方程计算a的值,进而计算生成的二氧化碳,
根据v=
| ||
| △t |
根据转化率等于计算CO的平衡转化率;
Ⅱ、(1)化合价升高的元素被氧化;
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数;
(3)计算废水中KCN的质量,再根据n=
| m |
| M |
解答:解:Ⅰ(1)可逆反应:
Fe2O3(s)+CO(g)?
Fe(s)+CO2(g)的平衡常数表达式k=
,
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:
;<;
(2)此时浓度商Qc=1,小于平衡常数4,反应向正反应进行,令参加反应的CO为amol,则:
Fe2O3(s)+CO(g)?
Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):a a
平衡(mol):1-a 1+a
反应前后气体的化学计量数不变,利用物质的量代替浓度计算平衡常数,故
=4,解得a=0.6,
故v(CO2)=
=0.006mol/(L?min);
CO的平衡转化率为
×100%=60%,
故答案为:0.006mol/(L?min);60%;
Ⅱ、(1)反应中C元素化合价由KCN中+2价升高为KOCN中+4价,C元素被氧化,
故答案为:C;
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O,
故答案为:2、4、3、2、1、6、2;
(3)废水中KCN的质量为650mg/L×20L=13000mg=13g,物质的量为
=0.2mol,使KCN完全转化为无毒物质,应生成CO、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,电子转移守恒可知2×n(Cl2)=0.2mol×(4-2)+0.2mol×[0-(-3)],解得n(Cl2)=0.5mol,故需要氯气的质量为0.5mol×71g/mol=35.5g,
故答案为:35.5.
| 1 |
| 3 |
| 2 |
| 3 |
| c(CO2) |
| c(CO) |
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:
| c(CO2) |
| c(CO) |
(2)此时浓度商Qc=1,小于平衡常数4,反应向正反应进行,令参加反应的CO为amol,则:
| 1 |
| 3 |
| 2 |
| 3 |
开始(mol):1 1
变化(mol):a a
平衡(mol):1-a 1+a
反应前后气体的化学计量数不变,利用物质的量代替浓度计算平衡常数,故
| 1+a |
| 1-a |
故v(CO2)=
| ||
| 10min |
CO的平衡转化率为
| 0.6mol |
| 1mol |
故答案为:0.006mol/(L?min);60%;
Ⅱ、(1)反应中C元素化合价由KCN中+2价升高为KOCN中+4价,C元素被氧化,
故答案为:C;
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O,
故答案为:2、4、3、2、1、6、2;
(3)废水中KCN的质量为650mg/L×20L=13000mg=13g,物质的量为
| 13g |
| 65g/mol |
故答案为:35.5.
点评:本题属于拼合型题目,涉及化学平衡常数及影响因素、反应速率计算、氧化还原反应基本概念及配平、计算等,难度中等,注意Ⅱ(3)中根据电子转移守恒计算,可以简化计算.

练习册系列答案
相关题目
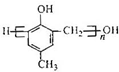 )的合成路线如下:
)的合成路线如下: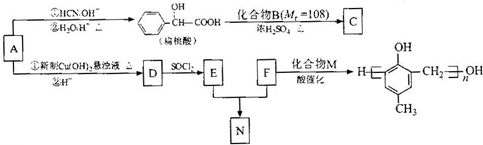
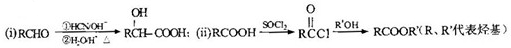
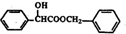
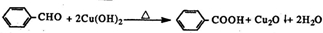
 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有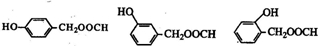 (任意一种)
(任意一种)