题目内容
1)在Fe3O4+4CO
3Fe+4CO2的反应中,
2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目,
①还原性 ②酸性 ③氧化性?
| ||
四氧化三铁
四氧化三铁
是氧化剂,一氧化碳
一氧化碳
是还原剂,碳
碳
元素被氧化,铁
铁
元素被还原.2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目,
1
1
Cu+4
4
HNO3(浓)-1
1
Cu(NO3)2+2
2
NO2↑+2
2
H2O浓硝酸表现出来的性质是②③
②③
(填写编号).?①还原性 ②酸性 ③氧化性?
分析:1)根据化合价的变化判断氧化剂、还原剂;
2)根据氧化还原反应中得失电子数相等配平方程式,根据硝酸中元素的化合价是否变化判断硝酸具有的性质.
2)根据氧化还原反应中得失电子数相等配平方程式,根据硝酸中元素的化合价是否变化判断硝酸具有的性质.
解答:解:1)在Fe3O4+4CO
3Fe+4CO2的反应中,化合价的变化为:Fe3O4→Fe,铁元素由+
(平均化合价)价→0价,得电子,所以Fe3O4作氧化剂,铁元素被还原;CO→CO2,碳元素由+2价→+4价,失电子,所以CO作还原剂,碳元素被氧化,故答案为:四氧化三铁;一氧化碳;碳;铁;
2)该反应中元素的化合价的变化为:HNO3→NO2,氮元素由+5价→+4价,一个氮原子得一个电子,硝酸作氧化剂;Cu→Cu(NO3)2,铜元素由0价→+2价,一个铜原子失2个电子;所以其最小公倍数为2,二氧化氮的计量数为2,铜的计量数为1,然后再根据原子守恒配平方程式.
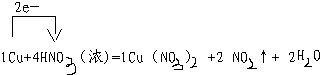
由HNO3→Cu(NO3)2氮元素的化合价没变,所以硝酸起酸的作用.
故答案为: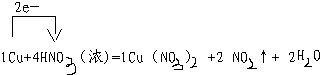 ;
;
选②③
| ||
| 8 |
| 3 |
2)该反应中元素的化合价的变化为:HNO3→NO2,氮元素由+5价→+4价,一个氮原子得一个电子,硝酸作氧化剂;Cu→Cu(NO3)2,铜元素由0价→+2价,一个铜原子失2个电子;所以其最小公倍数为2,二氧化氮的计量数为2,铜的计量数为1,然后再根据原子守恒配平方程式.
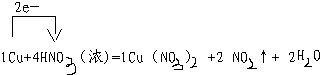
由HNO3→Cu(NO3)2氮元素的化合价没变,所以硝酸起酸的作用.
故答案为:
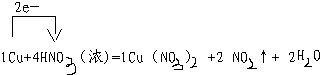 ;
;选②③
点评:本题考查了氧化还原反应的配平及氧化剂、还原剂的判断,准确判断化合价的变化是解本题的关键.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
