网址:http://m.1010jiajiao.com/timu_id_447938[举报]
选择题答案(18×3=54分)
题号
1
2
3
4
5
6
7
8
9
答案
C
A
C
C
D
B
B
C
A
题号
10
11
12
13
14
15
16
17
18
答案
D
C
B
B
D
D
A
D
B
二、填空题
19(6分).(1)12 (2)6 (3)2
20 (8分)(1)碳碳双键、醛基
(2)OHCCH.files/image010.gif) CHO+4Ag(NH
CHO+4Ag(NH.files/image018.gif) )
).files/image010.gif) OH
OH.files/image021.gif) 4Ag+NH
4Ag+NH.files/image023.gif) OOCCH
OOCCH.files/image010.gif) COONH
COONH.files/image023.gif) +6NH3+2H
+6NH3+2H.files/image010.gif) O
O
.files/image027.jpg) (3)HOCH
(3)HOCH.files/image010.gif) CH
CH.files/image010.gif) CH
CH.files/image010.gif) OH+HOOCCH
OH+HOOCCH.files/image010.gif) COOH
COOH
酯化反应(取代反应)
21(12分):(1)自来水含有电解质,会使胶体聚沉
(2)浓度太小不利于生成胶体
(3)加热会使胶体聚沉
(4)丁达尔效应,渗析,在渗析液中加入AgNO3溶液,若无明显现象则证明完全分离。
三、实验题:
22(11分)(1)坩埚钳、酒精灯(可以不答“火柴”)
(2)步骤②有错误 应先将试样研细,后放入坩埚称重
(3)因硫酸钠放置在空气中冷却时,会吸空气中的水分
(4)保证试样脱水完全
(5)B、D、F
.files/image032.jpg) 四、计算题(9分)
四、计算题(9分)
23.(9分)分子式C6H6O(5分) 结构简式 (4)
下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有 ( )
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+![]() O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+![]() O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+![]() O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
A.①② B.③④ C.②④ D.①③
查看习题详情和答案>>
下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有 ( )
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+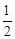 O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+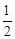 O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+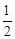 O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
A.①② B.③④ C.②④ D.①③
查看习题详情和答案>>
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+
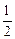 O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+
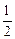 O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1H2(g)+
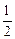 O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1| A.①② | B.③④ | C.②④ | D.①③ |
下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有( )
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+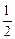 O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+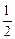 O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+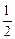 O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
| A.①② | B.③④ | C.②④ | D.①③ |
CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
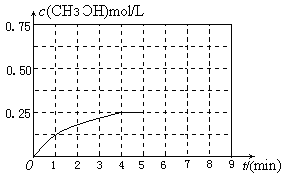
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。
(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)=" 0.2" mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ) 查看习题详情和答案>>