题目内容
下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有( )
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+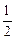 O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+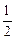 O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+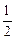 O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+
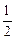 O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+
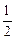 O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1H2(g)+
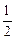 O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1| A.①② | B.③④ | C.②④ | D.①③ |
D
①~④所列的8个热化学方程的△H均为负值,即都表示是放热反应, 故只需比较Q值的大小即可。注意本题不是比较△H的大小而是比较Q值的大小。①中,强酸强碱的中和热大于弱酸强碱的中和热,所以①中Q1>Q2,②中C完全燃烧放出的热量Q2大于物质的
故只需比较Q值的大小即可。注意本题不是比较△H的大小而是比较Q值的大小。①中,强酸强碱的中和热大于弱酸强碱的中和热,所以①中Q1>Q2,②中C完全燃烧放出的热量Q2大于物质的 量的C不完全燃烧放出的热量Q1,所以Q2>Q1,③中两热化学方程式相减得:4Al(s)+2Fe2O3(s)=4Fe(s)+2Al2O3(s);△H =-Q1-(-Q2)<0,所以Q1>Q2,④中等物质的量的H2燃
量的C不完全燃烧放出的热量Q1,所以Q2>Q1,③中两热化学方程式相减得:4Al(s)+2Fe2O3(s)=4Fe(s)+2Al2O3(s);△H =-Q1-(-Q2)<0,所以Q1>Q2,④中等物质的量的H2燃 烧生成液态水放出的热量多,故Q2>Q1。
烧生成液态水放出的热量多,故Q2>Q1。
 故只需比较Q值的大小即可。注意本题不是比较△H的大小而是比较Q值的大小。①中,强酸强碱的中和热大于弱酸强碱的中和热,所以①中Q1>Q2,②中C完全燃烧放出的热量Q2大于物质的
故只需比较Q值的大小即可。注意本题不是比较△H的大小而是比较Q值的大小。①中,强酸强碱的中和热大于弱酸强碱的中和热,所以①中Q1>Q2,②中C完全燃烧放出的热量Q2大于物质的 量的C不完全燃烧放出的热量Q1,所以Q2>Q1,③中两热化学方程式相减得:4Al(s)+2Fe2O3(s)=4Fe(s)+2Al2O3(s);△H =-Q1-(-Q2)<0,所以Q1>Q2,④中等物质的量的H2燃
量的C不完全燃烧放出的热量Q1,所以Q2>Q1,③中两热化学方程式相减得:4Al(s)+2Fe2O3(s)=4Fe(s)+2Al2O3(s);△H =-Q1-(-Q2)<0,所以Q1>Q2,④中等物质的量的H2燃 烧生成液态水放出的热量多,故Q2>Q1。
烧生成液态水放出的热量多,故Q2>Q1。
练习册系列答案
相关题目
 CH3OH(g)
CH3OH(g)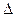 H1
H1 .2mol·L-1,则CO的转化率为 ,此时的温度
.2mol·L-1,则CO的转化率为 ,此时的温度 CH4(g)+3/2O2(g)
CH4(g)+3/2O2(g) l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)
l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)  T1℃时催化效率最高,能使正反应速率加快约3×105倍;
T1℃时催化效率最高,能使正反应速率加快约3×105倍;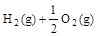 =H2O(g) △H1=a kJ
=H2O(g) △H1=a kJ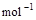 , ②
, ②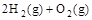 =2H2O(g)△H2=b kJ
=2H2O(g)△H2=b kJ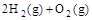 =2H2O(l)
=2H2O(l)  CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1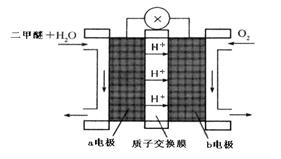
 2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示。则下列结论正确的是( )
2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示。则下列结论正确的是( )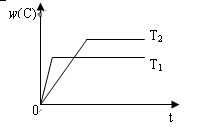
 C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
